Az iBAT szimpatikus beidegződése nem szükséges a központi leptin-szállítás által kiváltott testsúlycsökkenéshez
Farmakológiai és Terápiás Tanszék, Floridai Egyetem, Gainesville, Florida
Farmakológiai és Terápiás Tanszék, Floridai Egyetem, Gainesville, Florida
Farmakológiai és Terápiás Tanszék, Floridai Egyetem, Gainesville, Florida
Pszichiátriai Osztály, Floridai Egyetem, Gainesville, Florida
Öregedés és geriátriai kutatások tanszéke, Floridai Egyetem, Gainesville, Florida
Farmakológiai és Terápiás Tanszék, Floridai Egyetem, Gainesville, Florida
Farmakológiai és Terápiás Tanszék, Floridai Egyetem, Gainesville, Florida
Az újranyomtatási kérelmek és egyéb levelezések címe: P. J. Scarpace, Farmakológiai és Terápiás Tanszék, Univ. Florida, 1200 Newell Dr., Gainesville, FL 32610 (e-mail: [e-mail védett]).
Absztrakt
Értékeltük a barna zsírszövet (BAT) szimpatikus beidegződésének hozzájárulását a központi leptin által közvetített súlycsökkenéshez. Rövid és hosszú távú vizsgálat során az F344BN patkányoknak vagy interscapularis BAT denervációját (Denervated), vagy álverziós műtétet (Sham) vetették alá. Az egyes csoportok állatai megkapták a Ob (Leptin) vagy zöld fluoreszcens fehérje (GFP; Control) gén rekombináns adeno-asszociált vírus egyetlen injekciójával központilag. A testtömeg változását 14 vagy 35 napig regisztrálták, majd a zsírszöveteket és a vázizmokat lemérték. Mindkét vizsgálatban a hipotalamusz-foszforilált STAT3 (P-STAT3) szignifikánsan magasabb volt a Sham-Leptin és a Denervated-Leptin csoportokban, mint a megfelelő kontroll csoportokban (P -/- az egerek ellenállnak az étrend okozta elhízásnak (20) és alkalmazkodni tudnak a hideg környezethez (32).
Annak eldöntésére, hogy az iBAT szimpatikus beidegzése szükséges-e a centrális leptin által kiváltott testsúlycsökkenéshez, rövid és hosszú távú vizsgálatot végeztünk, rekombináns adeno-asszociált vírus (rAAV) konstrukciót alkalmazva, amely Ob (Leptin) vagy zöld fluoreszcens fehérje (GFP; Kontroll) gén iBAT-denervált (denervált) vagy áloperált patkányokban (ál). A testtömeg, a testösszetétel és az ételfogyasztás változását 14 napig (rövid távú vizsgálat) vagy 35 napig (hosszú távú vizsgálat) rögzítették, majd ezt követően lemérték a zsírszöveteket és a vázizmokat.
Állatok.
Hat hónapos hím Fisher 344 × Brown Norway (F344BN) hím patkányokat a Charles River Laboratories (Wilmington, MA) Országos Öregedési Gyarmat Intézetéből szereztünk be. Felnőtt F344BN patkányokat viszonylag stabil testtömegük alapján szelektáltunk a táplálékhoz való ad libitum hozzáférés mellett, összehasonlítva más patkány törzsekkel. Megérkezés után az állatokat egyenként 12: 12 órás világos-sötét ciklusban helyezték el, és a környezeti hőmérsékletet 20–23 ° C-on tartották. Valamennyi patkánynak legalább 1 hét múlva hagyták alkalmazkodni új környezetéhez, mielőtt bármilyen kísérletet megkezdenének. A patkányokat standard rágcsáló-chow-val etették (18% kcal zsírból, szacharóz nélkül, 3,1 kcal/g, Diet 2018; Harlan Teklad, Madison, WI). Egészségi állapotát, testtömegét és táplálékfelvételét naponta ellenőrizték a vizsgálat során. Valamennyi kísérleti protokollt a Floridai Egyetem Állattenyésztési és Felhasználási Bizottsága hagyta jóvá, összhangban a Útmutató a laboratóriumi állatok gondozásához és használatához.
Műtétek és csoportok.
A testösszetétel meghatározása időtartományú magmágneses rezonancia segítségével.
A testösszetételt hetente határoztuk meg 0. nap időtartományú magmágneses rezonancia (TD-NMR; Minispec; Bruker Optics, The Woodlands, TX) alkalmazásával. A MiniSpec a testösszetétel három összetevőjét számszerűsíti (zsírtömeg, szabad testfolyadék és sovány testtömeg). A TD-NMR felveszi és elemzi a minta területén lévő összes proton jelét. A felvételeket addig kaptuk, amíg a patkányokat az analizátorba helyezett henger alakú eszközbe visszatartottuk. A végső értékek két állat átlagának átlagát tartalmazták.
A szövetek összegyűjtése, betakarítása és előkészítése.
Patkányokat eutanizálták 2. hét (rövid távú tanulmány) vagy 5. hét (hosszú távú vizsgálat) altatásban (5% izoflurán) 3-6 órával a fényciklusuk vége után, thoracotomiával és exsanguination-el. Számos szervet és szövetet eltávolítottak és lemértek (Mettler AE 163): hipotalamusz, zsírraktárak (mesenterialis, perirenalis, epididymalis, retroperitoneális és iBAT) és izmok (gastrocnemius, soleus, plantaris, tibialis anterior és extensor digitorum longus). A hipotalamust mediális bemetszéssel boncoltuk az agyból a piriform lebenyekre, caudalisan a optikai chiasmra és az agyi crusszió elé 2,5 mm mélységig. A hipotalamust és az iBAT-ot 270 μl homogenizációs pufferben (10 mM Tris · HCl, pH 6,9 és 2% SDS foszfatáz/proteáz inhibitorok jelenlétében, Thermo Scientific, Rockford, IL) ultrahanggal kezeltük. A homogenátumokat, szöveteket és plazmamintákat az elemzés elvégzéséig -80 ° C-on tároltuk.
Nyugati elemzések.
A fehérje-lizátumokat SDS-PAGE gélen elválasztottuk és nitrocellulóz membránokra helyeztük. Az immunreaktivitást ECL prime-vel (GE Healthcare, Piscataway NJ) detektáltuk, ChemiDoc XRS + -val (Bio-Rad, Hercules, CA) szkenneltük és ImageJ szoftver segítségével számszerűsítettük. Valamennyi értéket, a kontrollokat is beleértve, az Ál-Kontroll csoport átlagához normalizáltuk, és százalékban jelentettük. Az iBAT termogenezis kapacitása szempontjából az immunreaktivitást az UCP1 elleni antitestekkel (Abcam, Cambridge, MA) értékeltük, és a terhelés kontrolljaként β-tubulinra normalizáltuk. A foszfo-STAT3-at (P-STAT3; Cell Signaling, Danvers, MA) úgy határoztuk meg, hogy összehasonlítottuk a foszforilezett fehérjére specifikus antitestek segítségével kapott jeleket a GAPDH antitesttel rögzített jelekkel.
A szöveti trigliceridtartalom meghatározása.
A máj és az izom triacil-glicerin-koncentrációit az etanolos KOH-hidrolízis után felszabaduló glicerinből becsültük egy kereskedelmi készlet segítségével (Sigma, St. Louis, MO). Frayn és Maycock (12) kimutatták, hogy a foszfolipidek eltávolításának elhagyása csak ± 2% -os hibához vezet a szöveti triacil-glicerin tartalom meghatározásában.
Szérum leptin.
A szérum leptinszinteket enzim immunvizsgálatokkal határoztuk meg (patkány leptin ELISA készlet, EZRL-83K; Milipore, Waltham, MA). A leptint az eutanáziában (táplált állapotban) gyűjtött vérben mértük.
RT-PCR.
A hipotalamuszból teljes RNS-t izoláltunk TRI reagenssel (Sigma-Aldrich). Két mikrogramm RNS-t fordítottunk át komplementer DNS-be nagy kapacitású komplementer DNS reverz transzkripciós készletek alkalmazásával (Applied Biosystems, Waltham, MA). A leptin génexpresszióját SYBR Green Supermix alkalmazásával primerkészletekkel határoztuk meg, amelyek a vektorból előállított mutáns leptin (előre: 5′-GGCAACGTGCTGGTTATTGT-3 ′ és fordított: 5′-ATATCCATCACACTGGCGGC-3 ′) amplifikálására készültek, de nem a natív szekvenciából. Gapdh (előre: 5′-TCTCTGCTCCTCCCTGTTCT-3 ’és hátramenet: 5′-TACGGCCAAATCCGTTCACA-3’) használtunk háztartási génként. Az IQ-t (Bio-Rad) használtuk az amplifikációs szint kimutatására, és egy kezdeti lépéssel programoztuk 3 percig 95 ° C-on, majd 40 ciklust végeztünk 5 másodpercig 95 ° C-on és 15 másodpercig 60 ° C-on. Az összes reakciót két példányban futtattuk, és a mennyiségi meghatározáshoz a küszöbérték ciklusának átlagát (CT) használtuk. A célgének relatív mennyiségi meghatározását ΔΔCT módszerrel határoztuk meg. Röviden: a célgének CT-értékeit normalizáltuk (ΔCT = CTTarget - CTGapdh), és összehasonlítottuk őket egy kalibrátorral (ΔΔCT = ΔCTS minta - ΔCTCalibrátor). A relatív expressziót (RQ) az IQ szoftver (Bio-Rad) segítségével számítottuk ki.
statisztikai elemzések.
Az eredményeket átlag ± SE értékben fejezzük ki. Az átlagok közötti különbségeket statisztikai szignifikancia szempontjából teszteltük (P + a sejteket középvonalbeli struktúrákban osztották szét az injekció helyén a harmadik kamrában, az elülső kompressziótól a hátsó hipotalamuszig terjedve (9). A központi leptinreceptor aktiválódását az STAT3 (P-STAT3) foszforilációjának mérésével határoztuk meg, amely egy jelátviteli esemény a leptin receptor b (Ob-Rb) aktiválásához képest. A P-STAT3 elengedhetetlen az etetés és az energiafelhasználás leptin-szabályozásához (35). A Sham-Leptin és a Denervated-Leptin csoportok egyaránt szignifikánsan magasabb hipotalamusz P-STAT3 tartalmat mutattak (3. ábra, A és B; P 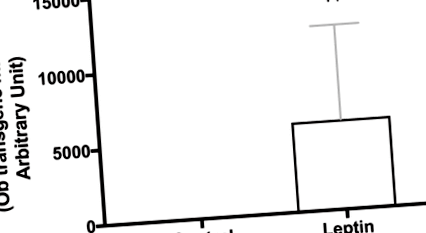
1. ábra.A leptin transzgén expressziójának megerősítése az agyban. A leptin transzgén expressziójának igazolására külön patkányok (azonos korú és törzsű) hipotalamuszát alkalmazták, amelyet ugyanazon kezelésnek vetettek alá, mint a hosszú távú vizsgálat során. Az értékeket többszörös expressziós szintként jelentik a kontroll vektorral injektált állatokban regisztrált szintek alapján (n = 10/csoport). ††P
2. ábra.A szérum leptin szintje. A és B: a rövid és hosszú távú vizsgálat végén mért szérum leptinszintek. †††P
3. ábra.Az alkalmazott kísérleti modell validálása. A és B: a leptin szignálaktivitás értékeléséhez a STAT3 foszforilációját patkányok hipotalamuszában értékeltük a rövid és a hosszú távú vizsgálat végén. C és D: az interscapularis barna zsírszövet (iBAT) termogén aktivitásának méréseként a rövid és a hosszú távú vizsgálat végén megmértük a protein 1 (UCP1) függetlenítését. Az értékeket átlag ± SE-ként fejezzük ki. ††P
A leptin által kiváltott összehasonlítható testtömeg és zsírtömeg-veszteség mind álszent, mind denervált állatoknál.
Korábbi vizsgálatainkkal összhangban a centrális leptin gén szállítása robusztus és tartós súlycsökkenést eredményezett (4. ábra, A és B) (9, 30). Rövid távú kísérletben szignifikáns különbségeket észleltünk a kontroll és a leptin csoport között 7. nap (4. ábraA; P
4. ábra.A testtömeg és a táplálékfelvétel heti változásai. A és B: a testtömeg napi és heti változását regisztráltuk a [delta (Δ)] testtömegben, kiszámítva a 0. nap - án rögzített testsúlytól 0. nap, 7, 14, 21, 28., és 35. A rövid távú vizsgálatban a Sham-Leptin és a Denervated-Leptin Δ testtömege szignifikánsan különbözött a 7. nap, és a különbségek e csoportok között statisztikailag szignifikánsak maradtak egészen 14. nap (P
A leptin gén szállítása gyorsan kiváltotta a zsír tömegét (5. ábra, A és B; P
5. ábra.A zsírtömeg és a sovány tömeg heti változásai. A és B: a zsírtömeget heti rendszerességgel értékelték az időtartomány (TD) -NMR alapján, és a Δfat tömeg heti változását kiszámítottuk az abszolút zsírtömeg levonásával. 0. nap alatt rögzített abszolút zsírtömegtől 0. nap, 7, 14, 21, 28., és 35. A rövid távú vizsgálat során a Δfat tömeg Sham-Leptinben (n = 8) és denervált leptin (n = 8) különbözött a megfelelő kontroll csoporttól (n = 7 a színlelt és n = 8 denervált kontroll esetén) 7. nap és 14 (P
A hosszú távú centrális leptin génterápia mind a színlelt, mind a denervált állatokban zsírtömeg atrófiát eredményezett.
Mint arról korábban beszámoltunk, a leptin gén beadása zsírszövet atrófiát eredményezett. Valójában a Sham-Leptin és Denervated-Leptin patkányok hasürege csak zsírnyomokat tartalmazott (1. táblázat). Mind a leptin, mind a denervációs kezelések az iBAT tömeg csökkenését okozták (5. ábraB; P
1. táblázat. A szövetek súlya
TA, tibialis anterior; EDL, extensor digitorum longus; iBAT, interscapularis barna zsírszövet.
*** P ‡ P ‡‡‡ P
6. ábra.A szöveti triglicerid (TG) tartalma. A és B: a máj TG-tartalmát a rövid és a hosszú távú vizsgálat végpontján mértük. Mindkét vizsgálatban a máj TG-tartalma szignifikánsan alacsonyabb volt a Leptin csoportokban a kontroll csoportokhoz képest. C és D: az izom TG-tartalmát a rövid és a hosszú távú vizsgálat végpontján mértük. A Leptin jelentős hatását a hosszú távú vizsgálatban figyelték meg, a rövid távú vizsgálatban azonban nem. A rövid távú vizsgálat során a denervált állatok szignifikánsan alacsonyabb izom-TG-szintet mutattak, mint a megfelelő ál-állatok. †††P
Az iBAT szimpatikus beidegződésnek a leptin által kiváltott fogyáshoz való hozzájárulásának megértése fontos az energia homeosztázist szabályozó endogén mechanizmusok teljes megértéséhez. A mai napig az UCP1 indukcióját továbbra is a leptin által kiváltott testsúlycsökkenés mögöttes mechanizmusának tekintik (8, 26). Kimutatták, hogy a leptin stimulálja az energiafelhasználást ob/ob egerek termogén kapacitásának növelésével, és feltételezték, hogy ez csökkent Ucp1 ezen egerek BAT-ban történő expressziója részben felelős az anyagcsere hatékonyságának fokozásáért és az elhízásra való hajlandóságért (8, 21). A krónikus leptinkezelés növeli az oxigénfogyasztást és csökkenti a zsírtömeget a vad típusú egerekben, de nem Ucp1-KO egerek, összehasonlítva a megfelelő kontroll páros táplált egerekkel (8, 26). Az iBAT termogenezis jelentőségét a leptin általános katabolikus hatása szempontjából azonban még soha nem sikerült megállapítani.
A BAT termogén potenciálja a magas mitokondrium-tartalomnak és az elektrontranszporttól független szubsztrát-oxidációnak tulajdonítható. Fontos, hogy a BAT a bevitt trigliceridek akár 50% -át és a bevitt glükóz 75% -át is oxidálhatja (24), ezzel demonstrálva a BAT képességét a szisztémás energia homeosztázis szabályozására. Bár az UCP1 fontos szerepet játszik az iBAT termogenezisében, azok az állatok, amelyek nem fejezik ki az Ucp1 a gén hideg körülmények között képes túlélni (23), sőt ellenállhat az étrend által kiváltott elhízásnak (10), ami arra utal, hogy az UCP1 nem szükséges az energia homeosztázis fenntartásához.
Ez a tanulmány rekombináns adeno-asszociált vírustechnikákat alkalmazott a központi leptin szignalizáció fokozására és annak igazolására, hogy az iBAT szimpatikus beidegződése elengedhetetlen-e a leptin által kiváltott testsúlycsökkenéshez. A centrális leptin túlexpressziója csak az álbetegség iBAT-jában indukálta az UCP1-et, és nem denervált patkányok iBAT-jában. Az UCP1 szintbeli különbségek ellenére mind a rövid, mind a hosszú távú vizsgálatokban hasonló testtömeg- és zsírtömeg-veszteséget figyeltek meg a denervált leptin és az ál-leptin állatok között. A testösszetétel-elemzések azt mutatták, hogy az állatok az első 14 nap során jelentős mennyiségű zsírtömeget vesztettek, amely utána stabil maradt. Úgy tűnik, hogy a zsírraktárak majdnem teljesen kimerültek 2 hét leptin gén szállítása után, ép és denervált patkányokban egyaránt. Ez a zsírtömeg gyors csökkenése alátámasztja a leptinre korábban megfigyelt katabolikus választ (22). Tekintettel a fehér zsírszövet (WAT) nagyon korlátozott mennyiségére, amely a vizsgálatok végén maradt, a jövőbeni kísérleteknek a WAT lipolízisének és a korábbi időpontokban történő átalakításának elemzésére kell összpontosítaniuk, mielőtt a WAT üzletek kimerülnének.
Jelen tanulmányok azt mutatják, hogy az iBAT szimpatikus beidegződése nem szükséges a központi leptin szignalizáció által közvetített súlycsökkenéshez. Ez a sebészeti modell felülmúlja a globális modellt Ucp1 kiesés, mert ezek az állatok nagyon heterogén kompenzációs alkalmazkodást mutatnak a metabolikus kihíváshoz (33). Továbbá, Ucp1 WAT-ban van kifejezve; ezért a kiütéses modell nem különbözteti meg a BAT termogenezisének hozzájárulását a WAT megbarnulásától. A modellünk egyik fontos korlátja, hogy az iBAT volt az egyetlen denervált BAT depó. Ezért nem zárhatjuk ki más ép BAT depók hozzájárulását. Lehetséges, hogy a mediastinalis, az axilláris, a perirenalis és a cervicalis BAT hozzájárult az iBAT-denervált állatok leptin-válaszához. A szimpatikus idegrendszeri aktivitást gátló új modellre az összes BAT depóban szükség van a BAT szimpatikus kiáramlás általános hozzájárulásának meghatározásához a leptinnel kezelt állatokban. Az interscapularis barna zsírpárna jelentőségét a BAT teljes termogenezisében az irodalom nem írta le világosan. Egyes egérvizsgálatok szerint az iBAT az összes BAT 60–70% -át teszi ki (1, 2), míg más jelentések szerint az iBAT csak az
Az összes barna zsírpárna 25% -a (33). A többparametrikus mágneses rezonancián alapuló ideghálózat automatikus szegmentálását alkalmazó új technikák segíthetnek az egyes BAT depók pontosabb számszerűsítésében (3). Kimutatták, hogy a testhőmérséklet elosztott szabályozás alatt áll, és lehetővé teheti a BAT funkciót károsító esemény kompenzálását (25). Következésképpen lehetséges, hogy az iBAT denerváció olyan perifériás kompenzációkat váltott ki, mint a WAT megbarnulása és/vagy az izomalapú NST növekedése, és a jövőbeni tanulmányoknak ezen mechanizmusok azonosítására kell törekedniük. Azt is jól dokumentálták, hogy az olyan mechanizmusok, mint a WAT fokozott lipolízise és/vagy csökkent lipogenezise fontos szerepet játszanak a központi leptin által közvetített súlycsökkenésben (4). Sőt, bár a BAT-hoz való szimpatikus kiáramlás nem kritikus, lehetséges, hogy natív állapotban (denerváció nélkül) az iBAT-hoz való szimpatikus kiáramlás mégis részt vehet a leptin által közvetített testsúlycsökkenésben. Mindazonáltal, figyelembe véve a leptin szerepét a barna zsírszövet biológiájában, annak megállapítása, hogy az iBAT szimpatikus beidegződése nem szükséges a leptin által közvetített súlycsökkenéshez, rávilágít a leptin testtömeg-szabályozás szerepét megalapozó mechanizmusok összetettségére.
Összefoglalva megállapítottuk, hogy az UCP1 indukciója iBAT szimpatikus kiáramlásokon keresztül nem szükséges a leptin által közvetített súlycsökkenéshez. Az ál-Leptin és a Denervált-Leptin állatok azonos mértékben reagáltak mind a rövid, mind a hosszú távú vizsgálat során. A TD-NMR elemzések azt mutatták, hogy ezek az állatok hasonló arányban vesztették el a zsír- és a sovány testtömeget. A jövőbeli vizsgálatoknak meg kell vizsgálniuk más termogén útvonalak lehetséges hozzájárulását, például a WAT megbarnulását vagy az izomalapú termogenezist.
Ezt a munkát az Országos Cukorbetegség és Emésztési és Vesebetegségek Intézete támogatta DK-091710.
A szerzők nem jelentenek be pénzügyi vagy egyéb összeférhetetlenséget.
- Hogyan nyújthatja a nyirokelvezetés a fogyást és a test méregtelenítését Blys
- Varázslatos fogyókúrás fogyás és támogatja a test zsírkiválasztását a SlimFit Keto - Storm folyamatokat
- Hogyan érheti el álmai testét - Orion gyors fogyás program
- Hogyan befolyásolhatja a fogyás az izomtömeget, az anyagcserét és a testzsírt
- Hogyan segít a pisztácia nassolása a fogyás jobb kezelésében Walter Adamson Body Age Buster Medium