A légzőszervi vírusok hatása az immunogenitásra és a védelemre, amelyet az univerzális influenza vakcina jelölt indukál egerekben
Janelle Rowell
1 Szövetek és fejlett terápiák irodája, Amerikai Egyesült Államok Élelmiszer- és Gyógyszerügyi Hivatala, Silver Spring, Maryland, Amerikai Egyesült Államok
Chia-Yun Lo
1 Szövetek és Fejlett Terápiák Hivatala, Amerikai Egyesült Államok Élelmiszer- és Gyógyszerügyi Hivatala, Silver Spring, Maryland, Amerikai Egyesült Államok
Graeme E. Price
1 Szövetek és fejlett terápiák irodája, Amerikai Egyesült Államok Élelmiszer- és Gyógyszerügyi Hivatala, Silver Spring, Maryland, Amerikai Egyesült Államok
Julia A. Misplon
1 Szövetek és Fejlett Terápiák Hivatala, Amerikai Egyesült Államok Élelmiszer- és Gyógyszerügyi Hivatala, Silver Spring, Maryland, Amerikai Egyesült Államok
Roberta L. Crim
2 Vakcinák Kutatási és Felülvizsgálati Irodája, Amerikai Egyesült Államok Élelmiszer- és Gyógyszerügyi Hivatala, Silver Spring, Maryland, Amerikai Egyesült Államok
Priyanka Jayanti
2 Vakcinák Kutatási és Felülvizsgálati Irodája, Amerikai Egyesült Államok Élelmiszer- és Gyógyszerügyi Hivatala, Silver Spring, Maryland, Amerikai Egyesült Államok
Judy Beeler
2 Vakcinák Kutatási és Felülvizsgálati Irodája, Amerikai Egyesült Államok Élelmiszer- és Gyógyszerügyi Hivatala, Silver Spring, Maryland, Amerikai Egyesült Államok
Suzanne L. Epstein
1 Szövetek és fejlett terápiák irodája, Amerikai Egyesült Államok Élelmiszer- és Gyógyszerügyi Hivatala, Silver Spring, Maryland, Amerikai Egyesült Államok
Társított adatok
Minden lényeges adat a kéziratban található.
Absztrakt
Bevezetés
Az univerzális influenza oltások csökkenthetik a szezonális és járványos influenza betegségterheit. Kidolgoztunk egy univerzális vakcina jelöltet, amely konzervált influenza A vírus (IAV) antigének nukleoprotein (A/NP) és 2-es mátrix (M2) alapján készült. Korábbi vizsgálataink kimutatták, hogy a DNS-alapozás, majd az A/NP és M2-t expresszáló rekombináns adenovírusok keverékével történő stimulálás (A/NP + M2-rAd) [1, 2] vagy egyetlen intranazális A/NP + M2-rAd dózis [ 3, 4] megvédi a naiv állatokat a különböző törzsek és altípusok későbbi IAV-fertőzésétől, megelőzve a pusztulást és a súlyos fogyást.
Emberben a korábbi vagy folyamatban lévő fertőzéseknek a későbbi immunválaszokra gyakorolt hatását vizsgálták különféle vírusok és más kórokozók szempontjából [13–15]. Például a citomegalovírus-fertőzés befolyásolhatja az influenza elleni immunválaszokat [16]. Hasonlóképpen, az influenza vírus epitópjaira adott T-sejtek válaszai átfedhetnek a hepatitis C vírus [17] vagy az Epstein-Barr vírus [18–20] reakciójával. A többszörös IAV-fertőzéseknek való kitettség sorrendje szintén befolyásolhatja az immunválaszokat és az eredményeket. A vizsgálatok azt mutatják, hogy az immunprintelés az első influenza vírussal találkozik [21–23], ami befolyásolja a későbbi életben tapasztalható különböző IAV altípusokra való érzékenységet [24].
Az oltásokra adott válaszokat korábbi fertőzések is befolyásolhatják. A korai életkorban megkezdett fertőzések megváltoztathatják a későbbi oltásokra adott választ, esetleg csökkenthetik a hagyományos oltásokra adott válaszreakció képességét [15, 25–27]. Korábban kimutattuk, hogy az oltási előzmények befolyásolják az univerzális influenza elleni vakcinánk teljesítményét egerekben, ami az univerzális vakcinák által közvetített védelem fokozását vagy részleges gátlását eredményezi, a korábbi alkalmazott oltások jellegétől függően [28]. Ezért fontos lehet figyelembe venni az immunelőzményeket az új vakcinák értékelésekor.
Az emberi populációban nem lenne lehetséges az egyén minden fertőzésének katalogizálása, majd az oltásra gyakorolt hatás felmérése. Ugyancsak nehéz lenne modellezni a vírusfertőzések egész életen át tartó szekvenciáját, amely egyedileg egyedi. A korábbi fertőzések hatása azonban állatmodellekben tanulmányozható a gyakori kórokozók példáival, hogy reálisabb modellt nyújtson, mint önmagában a naiv állatok. Jelen tanulmányban elemezzük az akut légúti vírusfertőzés hatásait az univerzális influenza vakcina teljesítményére, ideértve az IAV-fertőzés elleni védelmet és az oltóanyag-antigénekre adott immunválaszokat.
Anyagok és metódusok
Vírusok
Az 1B humán rhinovírust, a B632 törzset (RV1B) az American Type Culture Collection-től (ATCC, Manassas, VA, USA) szereztük be. A vírust amplifikáltuk és tisztítottuk a korábban leírtak szerint [29]. Röviden, az RV1B-t amplifikáltuk H1 HeLa sejtekben (ATCC, CRL-1958). A sejteket fagyasztva-olvadással lizáltuk, majd az RV1B-t kicsaptuk polietilénglikol 6000 alkalmazásával. A vírust megtisztítottuk és centrifugális szűrőberendezéssel (Amicon Ultra 15 mL Filters (100 000 NMWL), MilliporeSigma, Burlington, MA) tisztítottuk. A szövetkultúra fertőző dózisának (TCID50) ötven százalékát H1 HeLa sejtekben történő titrálással határoztuk meg. A légzőszervi syncytialis vírust, az A2 törzset (RSV-A2) az ATCC-től nyertük, majd növesztettük és előállítottuk a korábban leírtak szerint [30]. Kimutatták, hogy az RV1B [31] és az RSV-A2 [32] szaporodik az egerek légúti traktusaiban.
Az alkalmazott influenza A és B vírustörzsek a következők voltak: egérhez adaptált A/Fort Monmouth/1/47 (H1N1) (A/FM) Earl Brown, Ottawa Egyetem [33], A/Udorn/307/72. (H3N2) (A/Udorn) és B/Ann Arbor/1/86 (B/Ann Arbor) Brian Murphytől, az Országos Egészségügyi Intézet allergiától és fertőző betegségektől szereztük be. A vírusokat embrionált tyúktojások vagy fertőzött egerek tüdőhomogenátjainak felhasználásával állítottuk elő, a korábban leírtak szerint [34].
Rekombináns adenovirális vakcinák
A replikációhiányos (E1 és E3 törölt) rekombináns adenovírus-5 (rAd) vektorokat, amelyek expresszálták az A/NP vagy M2 konzervált IAV antigéneket, korábban leírtak [35, 36]. Az influenza B vírus nukleoproteinjét (B/NP-rAd) expresszáló rekombináns adenovirális vektort [36] alkalmaztunk specificitás kontrollként, mert nem nyújt védelmet az IAV-fertőzéssel szemben.
Légzőszervi fertőzések
Az in vivo vizsgálatokhoz az egerek 10 4 TCID50 A/Udorn vagy 105 TCID50 B/Ann Arbor intranazális dózist kaptak 50 μl PBS-ben; 5 x 105 TCID50 RSV-A2 50 μl EMEM-ben (Mediatech, Manassas, VA), amely 1% FBS-t, 100 mM MgSO4-et és 50 mM HEPES-t tartalmaz [30]; 2 x 10 6 TCID50 vagy 2 x 107 TCID50 RV1B 50 μL PBS-ben. Az RV1B esetében a két különböző dózis mind immunválaszt váltott ki egerekben; az alacsonyabb dózist az állatok kivételével az összes állatcsoportban alkalmazták, amint azt a szöveg megjegyzi.
Oltás és kihívás
Az egereket intranazálisan immunizáltuk izoflurán érzéstelenítésben 1010 vírusrészecskével (vp) B/NP-rAd, vagy A/NP + M2-rAd-val (5x109 vp A/NP-rAd és 5x109 vp M2 keveréke). -rAd). Négy héttel később az egereket A/FM-vel fertőztük, az ábrákban szereplő dózisok felhasználásával, és nyomon követtük a testtömegét és a túlélést. Amint fent említettük, humánus végpontként 25% -os súlycsökkenést alkalmaztunk, és minden, a végpontot elérő egeret eutanizálták.
T-sejt válaszok az RV1B-re
A tüdősejteket 106 TCID50 RV1B-vel stimuláltuk újra, és az interferon-y választ enzimhez kapcsolt immunfolt (ELISPOT) segítségével határoztuk meg, a korábban leírtak szerint [35].
Az antitestek válaszai az RSV-A2-re
Preimmun szérumokat és immunszérumokat (három héttel a fertőzés után) egerekből nyertünk. Az RSV nukleoprotein (RSV-N) elleni szérum IgG antitesteket luciferáz immunprecipitációs rendszerrel (LIPS) értékeltük, Renilla luciferázzal jelölt RSV-A2 nukleoproteint alkalmazva, a korábban leírtak szerint [37]. Az egyes állatkísérletek szérummintáit egyetlen vizsgálattal teszteltük. A pozitív eredmény küszöbértékét minden egyes vizsgálathoz kiszámolták, a standard pre-immun szérumok átlagértékét meghaladó 5 szórás alapján.
Az immunválasz az influenza antigénjeire
Három héttel azután, hogy az egerek A/NP + M2-rAd-t kaptak, az egyes egerek tüdejét és lépsejtjeit IFN-γ-termelés szempontjából megvizsgáltuk a peptidekre reagálva az alábbiak szerint: a domináns NP CD8 epitóp a BALB/c egerekben NP147-155 (NP147), az M2 ektodomén, az M2e2-24 (M2e) konszenzus szekvenciáját, és az ELISPOT segítségével vezérli a SARS M209-221 (SARS) eljárást, a korábban leírtak szerint [2, 35]. A szérumokat ELISA módszerrel teszteltük az A/NP, B/NP és M2e influenza elleni IgG antitestekre, az A/PR/8/34 vagy B/Ann Arbor törzsből származó M2e peptiddel vagy rekombináns NP fehérjével bevont lemezeken [1, 2].
Statisztikai analízis
A statisztikai elemzéseket SigmaPlot (Systat Software, San Jose, CA, USA) segítségével végeztük. A túlélési adatokat log-rank teszttel elemeztük páros összehasonlítással, Holm-Sidak teszttel. A testtömeg elemzését a fertőzés után egyirányú ANOVA alkalmazásával végeztük egy olyan időpontban (amelyet egy nyíl mutat az ábrákon), amikor az összes csoport esetében 100% -os túlélést figyeltünk meg. A post hoc elemzések Holm-Sidak vagy Dunn módszerét alkalmazták, kontrollként az A/NP + M2-rAd csoportot. Az ELISPOT adatait kétirányú ANOVA vagy t-teszttel elemeztük, amint azt az ábra jelmagyarázata megfogalmazta. Többszörös összehasonlítást végeztek Holm-Sidak módszerrel az A/NP + M2-rAd csoporttal, mint a különböző inokulákat kapó állatcsoportok előre meghatározott kontrolljával, és a SARS peptiddel, mint a különböző stimuláló peptidek kontrollja egyetlen állatcsoporton belül. A 0,05 alatti P értékeket statisztikailag szignifikánsnak tekintettük, és ezeket az ábrák is megjegyzik.
Eredmények
A korábbi influenza A fertőzés javítja az A/NP + M2-rAd elleni immunválaszt
Korábban kimutatták, hogy az A/NP + M2-rAd univerzális vakcinajelölt széles keresztvédelmet nyújt egyetlen adag után. A legjobb védelmet az intranazális immunizálás hozta létre, amely útvonal hatékonyan generálja a nyálkahártya T- és B-sejtek immunitását [3], és jelenleg emberben alkalmazzák élő attenuált influenza vakcinákhoz. Az A/NP + M2 elleni oltás mind antitest, mind T-sejt válaszokat indukál, amint azt [38, 39] áttekintjük. Az intranazális immunizálás antitesteket és T-sejt-válaszokat vált ki, mind szisztémásan, mind lokálisan a légzőrendszerben. A tüdőben vannak olyan citotoxikus T-limfociták, amelyek képesek elpusztítani az influenza vírussal fertőzött célpontokat [40] és az NP147-155-specifikus pentamer + vagy tetramer + CD8 T-sejtek a tüdőben [2, 3,40].
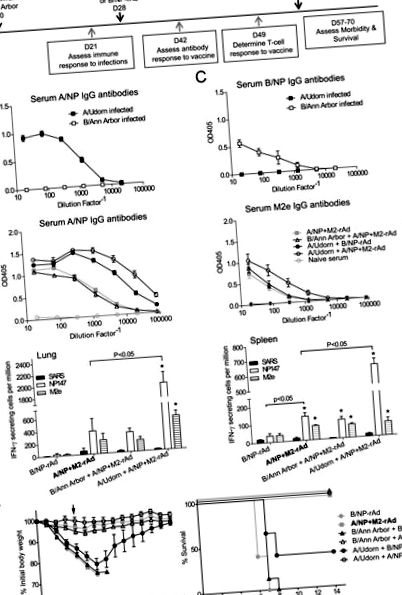
Először a korábbi influenzafertőzés hatását vizsgáltuk az univerzális vakcina jelölt későbbi teljesítményére (1A. Ábra). A/Udorn és B/Ann Arbor jól replikálódnak az egér tüdejében [41], de egerekben nem váltanak ki jelentős klinikai tüneteket. Három héttel később az egerek az A/NP vagy B/NP-re specifikus szérum IgG antitesteket termeltek (1B. És 1C. Ábra). Négy héttel a fertőzés után az egereket intranazálisan immunizáltuk A/NP + M2-rAd-val vagy B/NP-rAd-val, és további négy hét múlva influenza A/FM-vel fertőztük.
A súlyvesztés és a túlélési görbéket az 1F. Ábra mutatja. A korábban nem fertőzött kontroll egerekben egyedül az A/NP + M2-rAd védett a súlyos influenza betegség ellen, 100% -os túléléssel és minimális súlyvesztéssel. Tehát a túlélés végpontként csak a gátlást, de a fokozódást nem értékelheti ilyen körülmények között. Ugyanakkor vagy az oltóanyag-specifikus immunválaszok fokozása vagy gátlása, valamint a fogyás kimutatható lenne. A korábban A/Udorn-nal fertőzött egerek, majd A/NP + M2-rAd immunizálás minimális súlyveszteséget okozott a provokáció után, és 100% túlélte, az eredmény olyan jó, mint naiv egereknél az A/NP + M2-rAd. Az univerzális vakcina nélküli A/Udorn-fertőzés (A/Udorn, majd B/NP-rAd kontroll) szerény keresztvédő immunitást biztosított a nem megfelelő A/FM-vírus ellen. Az egerek jelentős testsúlycsökkenést és 40% -os túlélést mutattak. A B/Ann Arbor korábbi expozíciója nem befolyásolta szignifikánsan az oltás eredményét, amelyet az influenza A okozta. A B/Ann Arbornak, majd az A/NP + M2-rAd-nak kitett egerek minimális testsúlycsökkenést mutattak, összehasonlítva az előzetes expozíció nélküli egerekkel, és az összes egér túlélte az IAV-fertőzést. A B/Ann Arbort és a kontrollimmunizációt (B/NP-rAd) kapott egerek jelentős súlyt vesztettek az A/FM-fertőzést követően, és az összes egér megadta magát.
Az RSV-A2 vagy RV1B vírusok nem befolyásolják az oltások védelmét
Az oltás előtt hosszabb időközönként végzett fertőzéseknek más hatása lehet, mint a közelmúltbeli fertőzéseknek. A jövőbeni vizsgálatok hosszabb időintervallumokkal foglalkozhatnak, hogy meghatározzák az oltásra gyakorolt hatást az előző fertőzés immunmemóriájának kialakulásának különböző pontjain. A különböző kórokozók különböző keresztreaktív epitópokat mutathatnak; példákat választottunk tanulmányozásra. A fertőzések hatása függhet a gazda genetikájától és a fertőző kórokozó vagy az oltóanyag dózisától is. A korábbi fertőzés okozta gyulladásos hatások és szövetkárosodások szintén szerepet játszhatnak. A jövőbeni tanulmányok foglalkozhatnak ezekkel a kérdésekkel. Az eddigi eredmények biztatást nyújtanak arra, hogy az NP + M2 vakcina nemcsak kórokozóktól mentesen reagál, hanem a légúti fertőzésben tapasztalt válaszadók reálisabb környezetében is.
A szokásos ajánlások szerint a hagyományos influenza elleni vakcinákat nem szabad beadni, ha a tervezett címzett beteg, de a közelmúltban fertőzöttek továbbra is jogosultak [43]. A közelmúltbeli fertőzés utáni oltás modellezéséhez értékeltük az A/NP + M2-rAd teljesítményét a légúti fertőzés után 7 nappal. A fertőzés utáni morbiditás és túlélés alapján az A/NP + M2-rAd által biztosított védelmet nem csökkentették az immunizálás előtt 7 nappal bekövetkező légúti vírusfertőzések. A legutóbbi fertőzések ellenére összehasonlítható szérum antitest- és tüdő-T-sejt-válaszokat is megfigyeltünk.
Eredményeink azt mutatják, hogy a korábbi A/Udorn-fertőzés keresztvédelmet vált ki, amelyet heterosubtipiális immunitásnak is neveznek. A heteroszubtipiás immunitást a szakirodalomban sokszor leírták egerekre és sok más állatfajra [38], és valószínűleg emberben is kiváltja [44–47]. Ebben az esetben az A/Udorn (H3N2) részben védett az A/FM (H1N1) ellen (az egerek 40% -a túlélte a fertőzést, 1F. Ábra). Ezzel szemben az A/NP + M2-rAd erőteljesebb immunválaszokat indukált, amelyek elegendőek voltak az összes egér védelmére.
Az M2e-re adott antitestek válaszai gyengék és változóak egerekben az influenza vírusfertőzés vagy a hidegen adaptált influenza vírussal való immunizálás után [1, 4,48–50]. Hasonlóképpen az embereknél az M2e-specifikus antitest válasz indukciója influenza fertőzés után igen változó [51–53]. Ezekkel a megállapításokkal egyetértésben az M2e-specifikus antitest választ nem indukálta A/Udorn fertőzés, majd B/NP-rAd immunizálás (1D. Ábra). Azonban a fókuszált immunizálás, például M2-rAd alkalmazásával, hatékonyabban indukálja az antitest választ. Korábbi munkák kimutatták, hogy a módosított M2 konjugátumokat vagy expressziós vektorokat alkalmazó immunizációs stratégiák hatékonyak az influenza-fertőzéssel szemben [35, 50, 54]. Míg korábbi tanulmányaink azt mutatták, hogy az M2-rAd önmagában nyújt védelmet, az A/NP + M2-rAd a két komponens önmagában is magasabb szintű védelmet nyújt [1, 3].
Az adenovírus-vektoros vakcinák és génterápiák esetében valóban aggályos lehet a vektorral szemben meglévő immunitás által okozott interferencia [55, 56]. Az adenovírus 5-ös szerotípus (Ad5) iránti immunitás elterjedt az emberi populációban, és gátat szabhat az Ad5-alapú vektorok, például az ebben a vizsgálatban használt A/NP + M2-rAd univerzális vakcinajelölt későbbi alkalmazásának. Ennek a gátnak a leküzdése egyik módja egy olyan adenovírus-vektor használata, amelynek az emberek nincsenek kitéve. Korábbi munkánkban PanAd3-at, egy nem humán főemlős adenovírus-vektort használtunk ugyanabban a C Ad-fajban, mint Ad5 [57], az univerzális vakcinajelölt felépítéséhez, amely expresszálta a konzervált influenza A-antigéneket NP és M1. Az embereknél nagyon kevés vagy egyáltalán nincs szérum antitest a PanAd3 ellen, és egy univerzális vakcina ezzel a gerincvel védte az egereket az influenza okozta fertőzéstől [58]. Emellett úgy tűnik, hogy az rAd nyálkahártyán keresztüli beadása (i.n. vagy aeroszol) megkerüli az előzetes immunitás által okozott blokkolást [59, 60].
Jelen tanulmány az akut légúti fertőzéseket okozó vírusokra összpontosított. A vírusok, baktériumok és paraziták krónikus fertőzései szintén nagy hatással lehetnek a későbbi oltásokra adott gazda immunválaszaira [15, 25–27]. Tekintettel a már létező krónikus fertőzések magas arányára a világ számos részén, az immunizálásra gyakorolt hatásuk kiemelt fontosságú. Az itt vizsgált esetekre kiterjesztve a jövőbeni kutatások megvizsgálhatják a vakcina teljesítményét a krónikus fertőzés modelljeiben.
A vírustól és a fertőzés időpontjától függően az univerzális vakcinára adott immunválasz nem változott, fokozódott vagy mérsékelten csökkent az előzetes vírusfertőzés nélküli egerek válaszához képest. Végül az általunk tesztelt vírusfertőzések nem szüntették meg az univerzális vakcina által kiváltott védelmet. Ezek az eredmények ígéretesek, hogy a vakcina jól teljesíthet az emberben annak ellenére, hogy a közös légzőszervi vírusokkal szemben széles körű immunitás van.
Köszönetnyilvánítás
Köszönetet mondunk Mary Belchernek és Anthony Ferrine-nek, az FDA Vivarium-nak a szakértő állatgondozásért és a létesítmény üzemeltetéséért. Köszönjük Andrew Byrnes-nek és Maryna Eichelbergernek a kézirat éles áttekintését.
Finanszírozási nyilatkozat
Ezt a tanulmányt az amerikai FDA CBER intramurális kutatási finanszírozása támogatta, ideértve a CBER Pandemic Influenza kezdeményezés finanszírozását is. A finanszírozóknak a kéziratok kiértékelésének felülvizsgálati eljárásain kívül nem volt szerepük a tanulmányok tervezésében, adatgyűjtésben és elemzésben, a kézirat közzétételére vonatkozó döntésben vagy elkészítésében.
Adatok elérhetősége
Minden lényeges adat a kéziratban található.
- A pillangó hatása A pajzsmirigy túlméretezett hatása az egészségére, Marina Tarasova figyelemre méltó -
- Egy új anyatej-helyettesítő tápszer klinikai hatása kettős-vak székrekedéssel rendelkező csecsemőknél,
- A ki effektus Mi ez, és valóságos-e?
- Miért érdemes kipróbálni egy univerzális többkomponensű fehérje GymBeam Blogot
- A nagy dózisú zöld tea kivonat terápiás hatása a súlycsökkentésre Randomizált, kettős-vak,