Kallikrein
A kalikreinek a szerin-észterázok, amelyek széles spektrumú biológiai funkcióval rendelkeznek, beleértve a gyulladás, az apoptózis, a redox egyensúly és a vesék fibrózisának szabályozását.
Kapcsolódó kifejezések:
- Peptid
- Proteáz
- Trombin
- Bradykinin
- XII. Faktor
- Foszfoprotein
- Kinin
- Prekallikrein
- Beágyazott gén
- Mutáció
Letöltés PDF formátumban
Erről az oldalról
Molekuláris sejtbiológia
R.A. Bradshaw, R.L. Lundblad, a Sejtbiológiai enciklopédia, 2016
Kallikreinnel kapcsolatos peptidázok
A KLK család 15 fehérjéből áll (Harvey et al., 2000; Lundwall et al., 2006; 1. táblázat). Ezek többségének aktivitása nincs összefüggésben a KLK mint kininogenáz klasszikus meghatározásával (Kraut et al., 1930). A KLK-val rokon peptidázok szekréciós tényezőként funkcionálnak az extracelluláris térben, ahol különféle funkcióik vannak, ideértve a növekedési faktorok feldolgozását, az extracelluláris mátrixfehérjék hasítását és más proteázok aktiválódását. Részt vesznek a tumorogenezisben is (Dong et al., 2014).
A KLK2 és a KLK3 (PSA) a prosztata kizárólagos termékei, és prosztatarák szűrésre használták őket (Lövgren et al., 1995; Voigt et al., 2014). Kimutatták, hogy a KLK-val rokon peptidáz 2 (KLK2, hK2) kininogenáz aktivitással rendelkezik (Deperthes és mtsai., 1997; Charlesworth és mtsai., 1999), míg a PSA-nak kicsi (Andrade és mtsai., 2010), vagy nincs kininogenáz aktivitása (Deperthes és mtsai., 1997). Mind a KLK2, mind a PSA a prosztata elsődleges szekréciós termékeinek számít, és hasonlóan más KLK-val rokon peptidázokhoz, vannak alternatív splicingből származó termékek is (David et al., 2002).
Kimutatták, hogy az KLR-rokon peptidázok, amelyek tartalmazzák a szöveti kallikreint (1. táblázat), számos szövetben és folyadékban vannak jelen mRNS-analízissel és rendkívül érzékeny immunvizsgálatokkal (Shaw és Diamandis, 2007). A KLK-vel rokon peptidázok 5, 6, 7, 10, 11, 12, 13 és 14 jelenlétét a mirigyes hámsejtek citoplazmájában és a sejtszekrécióban immunhisztocitokémiával igazolták (Petraki et al., 2006).
A KLK-knak számos szubsztrátja van, amelyek figyelemre méltóak. Az inzulinszerű növekedési faktort megkötő fehérje (IGF-BP) proteinolízise a KLK család számos tagja által (1. ábra) megnövekedett, nem kötött inzulinnal kapcsolatos növekedési faktor-1 (IGF-1) értéket eredményez az interstitialis térben; a megnövekedett IGF-1 fokozza a tumor növekedését (Hekim et al., 2010). Számos más fehérjét javasoltak a KLK-szerű peptidázok szubsztrátjaiként (Borgono et al., 2007; Debela et al., 2008; Sotiropoulou és Pampalakis, 2010).
A különféle KLK-k és más proteázok közötti kapcsolat arra utal, hogy funkcionális kaszkádok léteznek (1. ábra), például komplement- és koagulációs proteázokkal megfigyelhetők, és ezek fontos szabályozási folyamatok (Blaber et al., 2010). Ezek a folyamatok nemcsak a zimogén aktiválódásával járnak, hanem interakciókat is folytatnak a proteáz-aktivált receptorok (PAR) által közvetített különféle sejtekkel. Ezek a feltételezett kaszkádok a proteázok lépésenkénti kölcsönhatását foglalják magukban, ahol az egyik enzim zimogén formája korlátozott proteolízissel átalakul aktivált formává. Aktiválása után ez a proteáz aktiválhatja a következő zimogént. A koagulációs kaszkádokkal ellentétben, ahol az iniciációs jel amplifikációja van, azt javasoljuk, hogy a kallikrein kaszkádok szabályozó jellegűek, és valószínűleg biztosítsák az események, például a szövetek átalakulásának időbeli ellenőrzését.
Kallikrein
Marty K.S. Wong, a Hormonok kézikönyvében, 2016
Absztrakt
Az emlősökben két fő kallikrein ismert. A plazma kallikrein (KLKB1) egyedülálló szerkezettel rendelkezik, négy alma-doménből és egy tripszin doménből. A szöveti (mirigyes) kallikrein (KLK) csak tripszin doménnel rendelkezik. A KLKB1 nagy molekulatömegű kininogénhez (KNG) kötődik nagy affinitással, és előnyösen felszabadítja a bradikinint (BK). A KLKB1 emészti a plazminogént a plazminhoz, és részt vesz a véralvadás, a fibrinolízis és a gyulladás felületfüggő aktiválásában. A Kallikrein átalakítja a prorenint reninné, hogy aktiválja a renin-angiotenzin rendszert. A teleosztátokban nem találtak KLKB1-et, de az immunfunkcióban szerepet játszó KLKB1-szerű lektint találtak. A KLK nagyon szelektív a [Lys0] -BK felszabadítására mind a nagy, mind az alacsony molekulatömegű KNG-kből. Ezenkívül a KLK részt vesz a sperma cseppfolyósításának proteolitikus kaszkádjaiban a szeminogelin hidrolízisén keresztül és a bőr serkentésén keresztül a sejtadhéziós fehérjék hasításával. A magas KLK3 expresszió a prosztatarák markere.
Kallikreinnel kapcsolatos peptidáz 5
Megkülönböztető tulajdonságok
A KLK5 proformagban 37 szermaradék propeptid van, amely messze a leghosszabb az összes KLK közül, és lehetővé teheti a jól dokumentált KLK5 autoaktiválást [9]. A kallikreinnel rokon peptidázok közül a legszorosabb rokonság a KLK4, KLK14 és KLK6, majd az összes többi ismert KLK és a tripszin következik [32]. Az érett KLK5 aminosav-azonossága más KLK proteázokkal 40% (KLK10) és 52% (KLK4) között mozog, a tripszin 47% -ban azonos aminosavakat mutat a KLK5-tel [59]. A KLK5 elleni kereskedelemben kapható antitestek tartalmazzák az egér monoklonális (R&D Systems, Abnova) és egér, kecske vagy nyúl poliklonális antitestjeit (R&D System, Abnova, LifeSpan BioSciences, Sigma-Aldrich).
Emberi Kallikrein 1, Tissue Kallikrein
Név és előzmények
A kallikreint az emberi vizeletben hipotenzív tulajdonságokkal rendelkező anyagként fedezték fel [1,2]. Hasonló anyagot detektáltak a hasnyálmirigyben, és a kallikrein (gör. Kallikreas, hasnyálmirigy) nevet kapták [3]. Ezt az enzimet nevezték el mirigyes kallikreinnek, valódi szöveti kallikreinnek, hasnyálmirigy-kallikreinnek, renális kallikreinnek és vizeletbeli kallikreinnek is. Az emberi szövet kallikrein gén szimbóluma a KLK1 [4]. Az emberi szövet egyéb kallikrein génjei közé tartozik a KLK2 (humán mirigyes kallikrein-1) és a KLK3 (prosztata-specifikus antigén vagy semenogeláz). Az emberi szövet kallikrein lókuszának részletesebb genomiális térképének elkészítése azt mutatta, hogy 15 gén jelentős szerkezeti hasonlóságot mutat [5,6] .
Kallikreinnel kapcsolatos peptidáz 7
Christopher J. Farady,. Fabrice A. Kolb, a Proteolitikus enzimek kézikönyve (harmadik kiadás), 2013
Név és előzmények
7. Kallikreinnel rokon peptidáz (KLK7) eredetileg a stratum corneum szövetből izolálták, mint kimotripszin-szerű aktivitású szerin proteázot, amely részt vett a terminálisan differenciált keratinociták szabályozott serkentésében [1,2]. Eredetileg elnevezték stratum corneum kimotriptikus enzim (SCCE), az emberi gén elhelyezkedése a 19q13.3-13.4 lokuszon az emberi 19. kromoszómán a kallikrein gének klaszterében, valamint a kallikrein család többi génjével szembeni nagyfokú szekvencia-homológia a gén átnevezéséhez vezetett. A KLK7 elsősorban a bőrben expresszálódik, de viszonylag magas szinten észlelhető a nyelőcsőben, a szívben, a májban, a központi idegrendszerben, a vese, a hasnyálmirigy, az emlő- és a nyálmirigyekben is [3,4]. A KLK7 biológiai szerepének jelenlegi megértésének nagy része az emberek és az egerek epidermális homeosztázisának kutatásából származik, ahol a KLK7 a kallikrein-szerű peptidáz-kaszkád része, amely felelős a bőrsorompó integritásának fenntartásáért.
Kallikreinnel kapcsolatos peptidáz 13
Daniela Cretu, Eleftherios P. Diamandis, a Proteolitikus enzimek kézikönyve (harmadik kiadás), 2013
Név és előzmények
Az emberi kallikreinek a szerin proteáz enzimcsalád (S1A) egyik alcsoportját képezik, amelyről úgy gondolták, hogy 1999-ig csak a három klasszikus kallikreint tartalmazta: KLK1 (hasnyálmirigy/vese kallikrein), KLK2 (emberi mirigyes kallikrein) és KLK3 (prosztata) specifikus antigén). Az emberi kallikreinnel rokon peptidázt 13 (KLK13) kódoló gént, amelyet korábban kallikrein-szerű génnek 4 (KLK-L4) [1] neveztek, strukturális homológia, valamint kromoszóma lokalizáció alapján kallikrein-szerű génként definiálják, és eredetileg a pozíciójelölt gén megközelítéssel izolálták [2]. A kibővített kallikrein család tagjai számára racionális nómenklatúrát fogadtak el, ahol a gént KLK13-ként, a megfelelő fehérjét pedig KLK13-ként ábrázolták, a HUGO Gén Nómenklatúra Bizottságának (HGNC) ajánlása szerint [3]. .
Hyaluronan a légutakban
ROSANNA FORTEZA,. GREGORY E. CONNER, a Hyaluronan kémiájában és biológiájában, 2004
IV. Szövet Kallikrein és Hyaluronan: kölcsönhatás és enzim gátlás
Az a tény, hogy a hyaluronan TK-hoz való kötődése gátolja enzimatikus aktivitását, e két molekula közötti specifikus kölcsönhatásra utal. Noha nincsenek olyan specifikus aminosav-szekvenciák, amelyek meggyőzően kimutatták, hogy általában kötik a hialuronán „motívumait”, sok hialuronán-kötő fehérje tartalmaz „linkmodulokat”, amelyek körülbelül 100 aminosav doménjei, négy cisztein-diszulfid-kötéssel és más erősen konzervált maradékokkal (36) A TK azonban nem tartalmaz ilyen link modult. Másrészt egyre nagyobb számban vannak olyan hialuronán-kötő fehérjék, amelyek nincsenek kapcsolatban egymással és nincsenek kapcsolati moduljuk. Valójában a TK kristályszerkezete (37) a bázikus aminosavak felületi klasztereit tárja fel a katalitikus hely közelében. Ezek az aminosavak jó jelöltek a hialuronán-kötődésre. Jelenleg azt vizsgáljuk, hogy ezek az aminosavak valóban felelősek-e a TK és a hialuronán specifikus kölcsönhatásáért.
A rákból származó enzimtermékek peptidomikája
Jia Fan,. Tony Y. Hu, Az enzimek, 2017
1.2.3 Kallikreins
A vese hormonjai
Anthony W. Norman, Gerald Litwack, Hormonok, 1987
IV. KALLIKREINEK ÉS BORÁK
Bevezetés
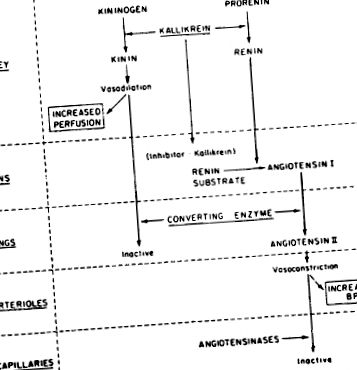
A kallikreinek a szerin proteázok egy csoportja, amelyek kininogénekként ismert plazma α2-globulinokra hatva kinineket, például bradikinint szabadítanak fel. A bradikinin a leghatékonyabb értágító anyag. Egyre több bizonyíték van a kallikrein-kinin rendszer és a prosztaglandin integrált kölcsönhatására a renin-angiotenzin rendszerrel a szisztémás artériás nyomás és a vese véráramlásának befolyásolása érdekében. A 15-14. Ábra a kallikrein – renin rendszer lehetséges összefüggéseit foglalja össze.
15-14. Ábra. Javasolt kallikrein – renin kölcsönhatások a szisztémás artériás nyomás és a vese véráramlásának fenntartása érdekében.
B Biokémia és élettan
A kallikreinek két osztályát azonosították: (1) a szervekben, elsősorban a vesében, de a nyálmirigyben és a hasnyálmirigyben, és (2) a plazmában találhatók. A plazma kallikreinek molekulatömege 107 000, míg a mirigyes kallikreinek kisebbek, molekulatömegük 27 000–43 000. Az összes kallikrein szerin proteáz. A plazma kallikrein általában pro-enzimként található, amelyet prekallikreinnek neveznek. A prekallikreint a véralvadási faktorok, a XII faktor vagy a Hageman faktor aktiválja kallikreinné. Viszont a Hageman-faktort a plazma kallikrein aktiválja. A vese kallikreint immunhisztokémiai technikákkal lokalizálták, hogy jelen legyen a disztális tekercselt tubulusban. Itt vélhetően szerepet játszik a vese véráramlásának növelésében és esetleg a prorenin reninné történő átalakulásának közvetítésében.
A kallikreinek proteázaktivitásukat felhasználva peptid kinineket szabadítanak fel prekurzor szubsztrát formájukból. A kallikrein szubsztrátnak két osztálya van: (1) azok, amelyek nagy molekulatömeggel vannak jelen a plazmában és amelyek felszabadítják a nonapeptid bradykinint, és (2) alacsony molekulatömegűek azokban a szövetekben, amelyek felszabadítják a dekapeptid kallidint. A kalidin vagy a lizil-bradykinin további lizint tartalmaz a bradykinin aminosav végén.
Legalább három összefüggés van a kallikrein – kinin rendszer, a renin – angiotenzin – aldoszteron rendszer és a vese prosztaglandinok között: (1) úgy tűnik, hogy a kallikrein enzim részt vesz a prorenin reninné történő átalakításában; (2) a kinináz II és az angiotenzin I konvertáló enzim enzimaktivitásai ugyanazon fehérje tulajdonságai; és (3) a prosztaglandinok termelését (és a vesén keresztüli kiválasztódást) fokozza a vese kininek termelése, míg a kallikrein csökkenti a prosztaglandinok termelését.
Az összes kininnek nagyon hasonló biológiai hatása van; erősen stimulálják a vese véráramlását, közvetítik a hipotenziót, növelik a vizelet áramlását és a nátrium kiválasztását. Kimutatták, hogy a bradikinin stimulálja a prosztaglandin PGA2 szintézisét, valószínűleg egy inaktív foszfolipáz aktív foszfolipázzá alakításával, amely felszabadítja a prosztaglandin szintézishez szükséges arachidonsavat a membrán foszfolipidjeiből.
Az emberi szövet Kallikrein és a Kallikreinnel kapcsolatos peptidáz család
Név és előzmények
606.1. Ábra A KLK lokusz elhelyezkedése a 19q kromoszómán13.4. A D19S425 és D193418 közötti intervallum sematikus ábrázolása. A KLK lokusz a D19S418 közelében található. A 15 kallikreint kódoló gének helyzete a KLK lókuszon meg van jelölve. A KLK1, KLK15, KLKP1-KLK14 telomer átírása centromérára, míg a KLK2 és KLK3 ellentétes irányba.
Ennek a családnak a nómenklatúrája is fejlődött az idők során; a jelenlegi szimbólumokat és más gyakran használt megnevezéseket vagy rövidítéseket a 606.1. táblázat ismerteti [14]. További figyelemre méltó, hogy a KLK1 vagy a szöveti kallikrein szekvenciájában és felépítésében meglehetősen különbözik a plazma kallikreintől (KLKB1, 638. fejezet), bár hasonló szubsztrát-specifitással rendelkeznek. Ez a fejezet kifejezetten leírja a humán KLK szerin-peptidáz család általános jellemzőit, valamint a KLK9 és KLK12 specifikus említését. A többi KLK enzim (KLK1-8, KLK10, KLK11 és KLK13–15) attribútumait külön fejezetekben írjuk le (607–614. Fejezet 607. fejezet 608. fejezet 609. fejezet 610. fejezet 611. fejezet 612. fejezet 613. fejezet 614).
606.1. Táblázat Az emberi kallikrein gének szimbóluma és megnevezése
- Levotiroxin - áttekintés a ScienceDirect témákról
- Lipstatin - áttekintés a ScienceDirect témákról
- Lipolízis - áttekintés a ScienceDirect témákról
- Indol-3-karbinol - áttekintés a ScienceDirect témákról
- Kefir - áttekintés a ScienceDirect témákról