Fejlesztési, genetikai, étrendi és xenobiotikus hatások az újszülöttek hiperbilirubinémiájára
Absztrakt
Bevezetés
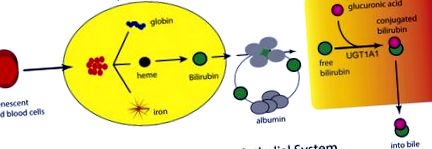
A bilirubin felszabadulása a vérbe és a májba történő szállítás. A születés utáni gyors oxigénnövekedés serkenti a vörösvértestek termelését és öregedését, ami azt eredményezi, hogy a retikuloendoteliális rendszer hem felszabadul a hemoglobinból. A hem a hemoxigenáz és a biliverdin reduktáz révén metabolizmuson megy keresztül, amelynek eredményeként a vérbe felszabaduló és a szérumfehérjékhez kötött bilirubin termelődik. A májba történő felvétele után a bilirubin az endoplazmatikus retikulumban található UGT1A1 révén glükuronidálódik. A bilirubin-glükuronid kilép a hepatocitából, ahol az epeúti csatornákon keresztül a belek üregébe hatol.
Ebben az áttekintésben dokumentáljuk, hogy az UGT1A1 aktivitását genetikai polimorfizmus befolyásolja, és a fejlődési szakaszban számos mechanizmus révén transzkripciós szinten szabályozza; az UGT1A1 gén genetikai elemei mellett a környezeti tényezők szerepére koncentráltunk az UGT1A1 bilirubin konjugációs képességének modulálásában. Hangsúlyt fektetnek olyan új állatmodellekből származó friss adatokra is, amelyek a bilirubin neurotoxicitására reagálva meghatározzák az agyban előforduló sejtes és molekuláris eseményeket. Végül új bizonyítékokat mutatunk be, amelyek arra utalnak, hogy a bilirubin metabolizmusa mind a máj, mind az extrahepatikus UGT1A1 aktivitással megvalósul.
Az 1A1 UDP-glükuronoszil-transzferáz a bilirubin encephalopathiát magában foglaló elsődleges enzim
Normál fiziológiai körülmények között a bilirubin rosszul oldódik vízben, ezért metabolizálódni kell, hogy lehetővé tegye a diszpozíciót és a kiválasztódást. Az UGT-k egy taghoz kötött enzimek családja, amelyek katalizálják a xenobiotikumok és az endogén szubsztrátok széles skálájának konjugációját glükuronsavval (Tukey és Strassburg, 2000). Az összes izoformából csak az UGT1A1 rendelkezik fiziológiai jelentőséggel a bilirubin metabolizálásához (Bosma és mtsai., 1994), amely a bilirubin epeürítésének és méregtelenítésének sebességkorlátozó lépése. Klinikai adatok és állatkísérletek alátámasztják azt a tényt, hogy a hiperbilirubinémiát elősegítő tényezőktől függetlenül a bilirubin méregtelenítését döntően az UGT1A1 gén expresszióját szabályozó szabályozó események határozzák meg.
Az UGT1A1 gén örökletes mutációi és a hiperbilirubinémiát segítő egyéb tényezők.
Az UGT1A1 gén veleszületett veleszületett hibái a megváltozott UGT1A1 expresszióval társulnak, és ezáltal csökkentik vagy teljesen megszüntetik a bilirubin konjugáló aktivitását. Az UGT1A1 gén több mint 40 öröklött mutációja társul a hiperbilirubinémiához, és az UGT1A1 aktivitás hiányának mértéke elsősorban a hiperbilirubinémia és az encephalopathia súlyosságát határozza meg (Tukey és Strassburg, 2000). A Gilbert-szindróma az UGT1A1 genetikai polimorfizmus enyhe formája, amely az UGT1A1 aktivitás enyhe csökkenését eredményezi (Kadakol et al., 2000; Strassburg, 2008), míg a Crigler-Najjar (CN) szindróma teljes eltörlést (1. típus) vagy súlyos redukciót mutat. UGT1A1 (2. típus) (Ciotti és mtsai., 1997). CN-betegeknél felfedeztek néhány kulcsmutációt az UGT1A1 gén kódoló régiójában és promóter régiójában; ezek a mutációk korrelálnak az UGT1A1 aktivitás csökkenésével vagy eliminációjával (Kadakol et al., 2000; Fujiwara et al., 2015). A klinikai adatok azt mutatták, hogy az 1. típusú CN kezeletlen csecsemőknél gyorsan kialakul az UCB magas plazmaszintje (20–50 mg/dl), ami súlyos neurológiai károsodás lehetőségének teszi ki őket.
Az UGT1A1 mutációk enyhe formái jóindulatú sárgaságot eredményeznek; más genetikailag meghatározott tulajdonságok összekapcsolásakor azonban súlyos hiperbilirubinémia léphet fel. Például azok a csecsemők, akiknek glükóz-6-foszfát-dehidrogenáz-hiány és rhesus-betegség által okozott hemolitikus állapotai vannak, hajlamosak lehetnek súlyos hiperbilirubinémiára (Huang et al., 2005; Bhutani et al., 2013). Beszámoltak arról, hogy a P-glikoprotein (P-gp) expressziója az agyban bilirubin neurotoxicitással is összefügg. A P-gp bőségesen expresszálódik az agy kapilláris endoteliális sejtjeiben és a vér-agy gátak asztrocitáiban, és képes a bilirubint az agyból a vér-agy gáton keresztül szállítani, membrán efflux pumpaként működve (Watchko et al., 1998, 2001). A vad típusú egerekhez képest az Mdr1a (P-gp kódoló gén) null egereknek magasabb volt az agy bilirubin tartalma, valószínűleg fokozott agyi bilirubin beáramlás révén, ami azt jelenti, hogy a vérgátban lévő Pgp expresszió szerepet játszik a központi idegrendszer elleni védelemben. bilirubin neurotoxicitás (Watchko et al., 1998, 2001). A fent említett genetikai tényezők mellett a koraszülés, az egyidejű betegség és a bilirubin-albumin kötődést gátló beavatkozások is a súlyos hiperbilirubinémia kockázati tényezőinek számítanak (Bhutani és Johnson, 2009).
Újszülöttkori hiperbilirubinémia és az UGT1A1 szabályozásának tanulmányozására létrehozott kísérleti modellek.
A felső panel a hUGT1A1 * 28 egerek genetikai hátterét mutatja. A felső ábra az emberi UGT1A lokusz ábrázolása, amelyet az egér genomjába illesztettek be (Tg-UGT1), az alsó ábra pedig az egér Ugt1 lokuszának célzott megszakadását mutatja be a neorezisztens gén inszerciójával a 4. exonba. panel (balra): Az Ugt1 -/- újszülött sárga sárgaságú sárgaság fenotípusos tulajdonságát mutatja, összehasonlítva az Ugt1 +/− egerekkel. Az Ugt1 -/- egerek többsége a 7. nap előtt pusztul el. Középső panel (jobbra): Az UGT1A1 expressziója újszülött májban és vékonybél szövetekben hUGT1A1 * 28 egerekben. Az alsó ábra a TSB összehasonlítását mutatja az Ugt1 -/- és a hUGT1A1 * 28 egerek között a fejlődési periódus alatt.
Felül: A Cre-loxP rekombinációs technológia alkalmazásával az Ugt1a1 gén (Ugt1 ΔHep vagy Ugt1 ΔIE) hepatocita- vagy bél enterocita-specifikus delécióját sikerült elérni. Az alsó diagram bemutatja az Ugt1a1 gén szövetspecifikus deléciójának hatását a szérum bilirubin szintjére.
Felső: A célkonstrukciót hordozó UFP egerek. Az Ugt1a1loxP [FRTneoFRT] loxP-t transzgenikus Albumin-Cre egerekbe tenyésztettük, hogy UGT1a1F/F/Albumin-Cre egereket (UAC egerek) állítsunk elő. Közép (balra): A TSB szintek összehasonlítása az UFP és az UAC egerek között a fejlődési periódus alatt. Középen (jobbra): A Kaplan-Meier túlélési görbék elemzik az UFP és UAC egerek túlélési arányát. Alsó rész: A túl magas bilirubinszint behatol a 15 napos UAC egér agyába.
Az UGT1A1 fejlesztési szabályozása.
Nyilvánvaló, hogy az UGT1A1 expresszió a fejlesztés során erősen szabályozott esemény. A hUGT1A1 * 28 egerek alkalmazásával a vizsgálatok kimutatták, hogy a máj UGT1A1 gén expressziójának csökkenését a fejlődési stádiumban, amely megfelel a hiperbilirubinémia kialakulásának és a magas TSB szintnek, a pregnán X receptor (PXR) aktívan szabályozza. Fordított genetikai kísérletek PXR-hiányos egerek felhasználásával, humanizált UGT1 háttérrel kimutatták, hogy PXR hiányában az egerek szignifikánsan magasabb UGT1A1-szintet fejeztek ki a TSB-szint csökkenésével, elkerülve a súlyos újszülöttkori hiperbilirubinémiát (Chen és mtsai, 2012). Ezek a megállapítások erősen jelzik, hogy a PXR az UGT1A1 gén transzkripciós represszoraként működik az újszülöttkori időszakban, és ez fejlődési eseményként van szabályozva, mivel a máj UGT1A1 génjének aktiválódását felnőtt hUGT1/Pxr -/- egereknél nem figyelték meg.
Bilirubin által kiváltott neurotoxicitás
Az oxidatív stressz BIND-ben betöltött szerepének értékeléséhez szulfadimetoxin indukálta sárgított Gunn patkány újszülötteknek antioxidánsokat adtak, hogy megváltoztassák redox állapotukat, ami csökkent lipidperoxidációt eredményez; Az oxidatív stressz gátlása azonban nem vezetett a neurotoxicitás blokkolásához, mivel ezek a kölykök továbbra is neurobehaviorális rendellenességeket és bilirubin encephalopathiát mutattak, hasonlóan ahhoz, amit antioxidánsok hiányában a kontroll Gunn patkány kölyköknél megfigyeltek (Daood et al., 2012). Ezen eredmények egyik lehetséges magyarázata az, hogy az oxidatív stressz a betegség későbbi szakaszaiban jelentkezhet, nem pedig a kezdeti szakaszban, és a reaktív oxigénfajok a korai események, például gyulladásos válaszok eredményeként kialakuló idegsejt-degeneráció másodlagos megnyilvánulásai.
A kisagyból, a medullából, a ponsból és a corpus callosumból származó képek csökkent myelinizációt jeleznek, ezt mutatja a myelin bázikus fehérje (MBP, zöld) jelenléte csökkenése az idegsejtekben (neurofilamentum, piros).
A környezeti tényezők hozzájárulása a hiperbilirubinémiához
Anyatej sárgaság és az Extrahepatic UGT1A1 szerepe.
Az anyatej és a hiperbilirubinémia közötti kapcsolatot Arias és munkatársai írták le először 1964-ben (Arias et al., 1964). Az anyatej sárgaságának korai tanulmányai azt mutatták, hogy a progeszteron metabolitja, a pregnán-3-20-dio jelen van az anyatejben, és szerepet játszik a sárgaság kialakulásában (Hargreaves és Piper, 1971), bár végül nem sikerült tudományos konszenzust elérni. A mai napig nem mutattak be olyan specifikus komponenst vagy komponens-kombinációt, amely határozottan hozzájárulna az anyatej sárgaságához.
Azon elképzelésnek megfelelően, hogy a TSB-szint magasabb és hosszabb ideig tart az anyatejjel táplált csecsemőknél, a humanizált UGT1A1 * 28 egérmodellt használó kísérletek (Fujiwara et al., 2012) megismételték, hogy az anyatej etetése után bekövetkezett újszülöttkori hyperbilirubinemia eltűnt, amikor egerek tápszert kaptak. A hagyományos ismeretekkel ellentétben ez a tanulmány azonban tovább rávilágított arra, hogy az extrahepatikus UGT1A1, különösen a bél UGT1A1 expressziója tápszeres táplálással indukálható, és döntő fontosságú a bilirubin anyagcseréje és a clearance után a máj UGT1A1 aktivitásának postnatalis átmenete során, amely csak később jelentkezik., a szoptatási időszak végén (Chen et al., 2012; Fujiwara et al., 2012). Ezzel szemben az anyatej hozzájárul a hiperbilirubinémia kialakulásához azáltal, hogy elnyomja az UGT1A1 expresszióját a vékonybélben. Az anyatejről kiderült, hogy elnyomja a bél IĸB kináz α és β-t, ami az NF-ĸB nukleáris receptor inaktiválódását és a bél UGT1A1 expressziójának majdnem teljes eltörlését eredményezi (Fujiwara et al., 2012).
UGT1A1 ksenobiotikumok általi aktiválás nukleáris receptorokon keresztül.
Az UGT1A1 expresszió modulálása környezeti vegyi anyagokkal.
Amikor a hiperbilirubinémia újszülött egereket környezeti vegyi anyagoknak, arzénnak és kadmiumnak tették ki, TSB szintjük váratlanul csökkent, korrelált a bél UGT1A1 expressziójának megemelkedett szintjével, a máj UGT1A1 expressziójában nem észlelhető változások. A génexpressziós profiladatok és a biokémiai vizsgálatok azt mutatták, hogy az oxidatív stressz hatásos induktoraként az arzén és a kadmium megváltoztatja a belek redox állapotát, ami az UGT1A1 indukciójához és a TSB szintjének drámai csökkenéséhez vezet (Liu et al., 2016). Ezek az eredmények arra utalnak, hogy a bél UGT1A1 aktivitásának modulálása az oxidatív stressz jelátviteli út elindításával nem konvencionális alternatíva lehet a TSB csökkentésére és a hiperbilirubinémia javítására.
Alternatív megközelítések a hiperbilirubinémia kezelésére
Hepatocita transzplantáció és géntranszfer terápia.
A CNS1-ben szenvedő betegeknél a fototerápia gyakran az első vonalbeli terápia, de átmenetileg csökkentheti a szérum bilirubin koncentrációját, és a csecsemőkor után fokozatosan hatástalanná válhat. Jelenleg a májtranszplantáció a gyógyító kezelés a neurológiai következmények és a kernicterus megelőzésére, de gyakran folyamatos immunszuppressziót igényel, jelentős kockázatokkal (Schauer et al., 2003).
A bizonyítékok azt mutatják, hogy a normál UGT1A1 aktivitás csak ~ 5% -a elegendő a plazma bilirubin koncentráció jelentős csökkentéséhez és a kernicterus kockázatának kiküszöböléséhez (Fox és mtsai, 1998); ezért a kísérleti szakaszban alternatív terápiák folynak a hiperbilirubinémia enyhítésére az UGT1A1 enzim tartós expressziójával. Egy nemrégiben készült tanulmány azt illusztrálta, hogy az újszülött hepatociták előnye a felnőtt hepatocitákkal szemben abban rejlik, hogy az újszülött hepatociták transzplantáció után jobb befogadási és újratelepítési képességet mutatnak, ezáltal jobb bilirubin clearance-t eredményeznek az icterikus Gunn patkányokban (Tolosa et al., 2015). Jelentős előrelépés történt az elmúlt évtizedekben az adenovírus-alapú vagy hasonló technikákat alkalmazó génterápia vagy az UGT1A1 génhibák hely szerinti irányított génjavító megközelítéssel történő korrekciójával a hiperbilirubinémiás állatok kezelésében (Li et al., 1998; Kren et al. al., 1999; Roy-Chowdhury és mtsai, 2001; Bellodi-Privato és mtsai, 2005). Egy génterápiás vizsgálat kimutatta, hogy az UGT1A1-et expresszáló, segítőtől függő adenovírusvektor egyszeri injekciója, amely kifejezetten a májszövetet célozza meg, teljesen korrigálhatja az örökletes hiperbilirubinémiát Gunn patkányokban, hosszan tartó hatásokkal és alacsony krónikus toxicitással (Toietta et al., 2005).
Albumin beadása.
Az albumin bilirubin iránti nagy affinitásának eredményeként normális állapotban az UCB a májba keringéssel történő transzport után az albuminhoz kötődik (Ostrow és mtsai., 1994). Amikor az UCB szintje meghaladja az albumin kapacitását, a szabad bilirubin képes átjutni a vér-agy gáton és felhalmozódni az agyban. Ezért a bilirubin agyi felhalmozódásának megakadályozására szolgáló lehetséges megközelítés a bilirubin-kötő képesség növelése albumin-kiegészítéssel. Amikor az Ugt1a1 öröklött mutációit hordozó újszülöttkori hiperbilirubinémiás egereknek napi albumin infúziót alkalmaztak, megmentették őket a neurológiai károsodásoktól és a letalitástól. A plazma bilirubin-megkötő képességének növelésével az albumin mozgatja a bilirubint a szövetekből a plazmába, és a szisztémás plazma bilirubinszint csökkenését eredményezi (Vodret et al., 2015).
Ezeknek az alternatív kezeléseknek a hatékonyságától függetlenül még mindig kísérleti stádiumban vannak, és nyilvánvalóan klinikai vizsgálatokra van szükség az akut toxicitás, az immunogén válaszok és a hosszú távú biztonsági profil értékeléséhez, mielőtt azokat az emberek piacán alkalmazhatnák.
Fejlessze ki az UGT1A1 gén expressziójának kiváltására szolgáló terápiákat.
Az állatmodellek, például a humanizált UGT1A1 * 28 egerek használata segít meghatározni az újszülöttek hiperbilirubinémiáját szabályozó mechanizmusokat, és fontos helyet biztosít a biztonságos és terápiás vegyi anyagok hatásának kiaknázására az UGT1A1 gén és az alacsonyabb TSB szint szabályozására. Ezek a nem invazív megközelítések kihasználhatják a gyógyszer újszülöttekbe történő bejuttatásának előnyeit, vagy alternatívaként a szoptatós anyáknak történő gyógyszeres beadás utáni laktációt. A humanizált UGT1A1 * 28 egerekkel végzett in vivo vizsgálatok közvetlenül kihasználhatják a szövetspecifikus hozzájárulásokat, mint például a máj és a gyomor-bél traktus, amelyek közvetlen bilirubin-clearance-t nyújtanak, miközben képesek megvizsgálni az indukáló szerek farmakokinetikai paramétereit is.
Összegzés
A súlyos újszülöttkori hyperbilirubinemia és a bilirubin encephalopathia megelőzése továbbra is klinikai aggodalomra ad okot. A klinikai adatok azt mutatják, hogy míg a fiziológiás sárgaság az újszülötteknél gyakori jóindulatú állapot, további hemolízis források, amelyek fokozott hem katabolizmust és súlyos UGT1A1 hiányt eredményeznek, reverzibilis vagy irreverzibilis neuropatológiai állapotokhoz vezethetnek. Állatkísérletek során kiderült, hogy az UGT1A1 szintjét környezeti és étrendi vegyületek szabályozhatják a nukleáris receptorok aktiválásával vagy az oxidatív stressz állapotának megváltoztatásával. Míg a molekuláris és sejtes események komplex kaszkádja, amely bilirubin által kiváltott neurotoxicitáshoz és kernicterushoz vezet, továbbra sem teljesen körvonalazott, a felmerülő bizonyítékok azt mutatják, hogy a TSB magas szintje aktiválja a veleszületett immunitást és a mielináció károsodását okozza. Mivel az új toxikológiai modellek megjelenésével többet tudtunk meg a bilirubin anyagcseréről és a neurológiai sérülésekről, a hiperbilirubinémiával kapcsolatos hagyományos ismeretek egy része most megkérdőjelezhető: Az intesztinális UGT1A1 az anyatej és a környezeti vegyületek szabályozásának van alávetve, és kritikus szerepet játszik az a fejlődési stádium, amikor a máj UGT1A1 expressziója késik.
Rövidítések
| BIND | bilirubin által kiváltott neurológiai diszfunkció |
| CNS1 | 1. típusú Crigler-Najjar szindróma |
| PBREM | fenobarbitál-reagáló elem |
| P-gp | P-glikoprotein |
| PXR | pregnán X receptor |
| TSB | teljes szérum bilirubin |
| UAC | UFP/albumin-Cre |
| UCB | konjugálatlan bilirubin |
| UGT1A1 | UDP-glükuronozil-transzferáz 1A1 |
Szerzői közreműködés
Végzett kísérletek: Yueh, Chen, Nguyen, Tukey.
Adatelemzést végzett: Yueh, Chen, Nguyen, Tukey.
Írta vagy hozzájárult a kézirat megírásához: Yueh, Tukey.
Lábjegyzetek
A felülvizsgálat megírását részben a közegészségügyi szolgálatok támogatásai támogatták [ES010337, GM086713, GM100481, R21ES024818 és R21ES023906].
- Genetikai és környezeti hatások az elhízásra SpringerLink
- Az étrendi minőség befolyásolja a mikrobiom összetételét az emberi vastagbél nyálkahártyájában - ScienceDaily
- Az étrend befolyásolja a gazda – mikrobiota asszociációkat a Drosophila PNAS-ban
- A diéta befolyásolja a Helicobacter pylori kezelést - Thaiföldi orvosi hírek
- Az exogén étrendi keton-észter csökkenti a testtömeget és az adipozitást a