Diétás anyag
Kapcsolódó kifejezések:
- Aminosav
- Citokróm P450
- Anyagcsere
- Enzim
- Fehérje
- Jód
- Metabolit
- Étrend-kiegészítő
- Jódhiány
Letöltés PDF formátumban
Erről az oldalról
Szív-és érrendszeri betegségek
JAMY D. ARD MD, FRANK A. FRANKLIN Jr., a Klinikai táplálkozás kézikönyve (negyedik kiadás), 2006
Fitokémiai anyagok
A növényekből származó étrendi anyagok csökkenthetik a szérum teljes koleszterinszintjét és csökkenthetik a CHD kockázatát. Ilyen fitokémiai anyagok például a fitoszterolok, tokotrienolok és flavonoidok. A fitoszterolok olyan növényi szterolok, amelyek gátolják mind az endogén, mind az exogén koleszterin felszívódását, és csökkentik a szérum összes koleszterinszintjét. A szterinek táplálékforrásai közé tartoznak az árpa palántái, mandula, kesudió, földimogyoró, szezámmag, napraforgómag, teljes kiőrlésű kukorica, szójabab és sok növényi olaj. Növényi szterinekkel és sztanolokkal dúsított kereskedelmi kenőanyagok, például a Benecol és a Take Control beépíthetők a diszlipidémiás betegek kezelésébe. Az ATP III 2-3 gramm növényi szterin napi bevitelét ajánlja, ami 6–15% -kal csökkentheti az LDL-koleszterinszintet.
A tokotrienolok kémiailag rokonok a tokoferollal (E-vitamin). Állatokban és emberekben ezek az anyagok gátolják a HMG CoA reduktáz aktivitást és csökkentik a szérum teljes koleszterinszintjét. A tokotrienolok megtalálhatók a gabonamagvakban és a pálmaolajban. A flavonoidok antioxidáns polifenol vegyületek, amelyek mindenütt jelen vannak a zöldségekben, gyümölcsökben és növényi eredetű italokban, beleértve a teát és a vörösbort. A flavonoid bevitel fordítottan összefügg a CHD mortalitással, és megmagyarázza a CHD arányának szórásának jelentős részét, függetlenül annak táplálkozási forrásától. Ez arra utal, hogy a flavonoidok hatással vannak a CHD kockázatára, amely független a kapcsolódó étrendi tényezőktől.
Jód: élettan, étrendi források és követelmények
A jódra vonatkozó követelmények és étrendi források
Az Amerikai Orvostudományi Intézet (IOM) és az Egészségügyi Világszervezet (WHO) által meghatározott jódfelvétel kor és népességcsoport szerinti bontásban 2. táblázat . A jódhiány szempontjából leginkább kiszolgáltatott népességcsoportok a kisgyermekek és a terhes nők, megnövekedett fiziológiai szükségleteik miatt. A felnőttek tolerálható felső beviteli szintjét (UL) az Egyesült Államokban napi 1100 μg jód, az Európai Unióban pedig 600 μg jód határozza meg. A legtöbb ember számára nem valószínű, hogy az élelmiszerekből és kiegészítőkből származó jódbevitel meghaladja az UL-t.
2. táblázat Jódfogyasztásra (μg nap −1) vonatkozó javaslatok életkor és népességcsoport szerint
| 0–12 hónapos csecsemők | 110–130 | 0–5 éves gyermekek | 90 |
| 1–8 éves gyermekek | 90 | 6–12 éves gyermekek | 120 |
| 9–13 éves gyermekek | 120 | ||
| Felnőttek ≥14 év | 150 | Felnőttek ≥12 év | 150 |
| Terhes nők | 220 | Terhes nők | 250 |
| Szoptató nők | 290 | Szoptató nők | 250 |
Források: Az Egyesült Államok Orvostudományi Intézetének reprodukciója (2001): A-vitamin, K-vitamin, arzén, bór, króm, jód, vas, mangán, molibdén, nikkel, szilícium, vanádium és cink étrendi referencia-bevitele. Washington, DC: National Academy Press, az Egészségügyi Világszervezet engedélyével. Sokszorosítva az Egészségügyi Világszervezet, a Nemzetközi Jódhiánybetegségek Ellenőrzési Tanácsának engedélyével, az ENSZ Gyermekalapja (2007) A jódhiányos rendellenességek értékelése és monitorozásuk, 3. kiadás. Genf: Egészségügyi Világszervezet.
a Megfelelő bevitel 12 hónaposnál fiatalabb csecsemők számára; Ajánlott napi juttatás 1 évnél idősebb gyermekek számára. b Ajánlott tápanyag bevitel.
A legtöbb étel és ital natív jódtartalma alacsony. A legtöbb elfogyasztott étel adagonként 3–80 μg-ot tartalmaz. A növényi eredetű élelmiszerek általában kevés jódot tartalmaznak, és befolyásolja őket a talajtartalom, az öntözés és a műtrágyák használata. A tenger gyümölcsei és a moszat általában gazdag jódforrás. A halak jódtartalma azonban nagymértékben változik a lakott víz függvényében. Egyes országokban, például Japánban és Izlandon, ahol nagy a tenger gyümölcseinek fogyasztása, egyes lakossági csoportok túlzott mennyiségű jódot fogyasztanak.
Az étrendi jód legfontosabb forrása sok országban a jódozott só. A jód hozzáadása a sóhoz a leghatékonyabb módszer a jódhiány kezelésére, és a WHO, az ENSZ Gyermekalapja (UNICEF) és a Nemzetközi Jódhiányos Rendellenességek Ellenőrző Tanácsa (ICCIDD) azt javasolja, hogy a jódhiányos régiókban a sót 20–40 mg jód/kg só koncentrációban dúsítandó, a helyi sóbeviteltől függően. 1990 óta világszerte a jódozott sót használó háztartások aránya kevesebb, mint 20% -ról 70% -ra nőtt, ezáltal jelentősen csökkentve a jódhiány problémáját. Az anyatej jódtartalma az anya jód állapotától és az étrendi beviteltől függően változik. A kolosztrum tartalmazza a legnagyobb mennyiségű jódot, koncentrációja akár 200–400 μg l –1. Jódhiányos területekről származó nőkön végzett vizsgálatok szerint az anyatejben az átlagos jódtartalom 9–32 μg l –1 volt. Ezzel szemben a sójódosítás vagy a pótlás területein élő nők átlagos jódtartalma az anyatejben 25 és 155 μg l -1 között mozog .
A jódigényt befolyásoló étrendi és környezeti tényezők
A goitrogének olyan étrendi anyagok, amelyek zavarják a pajzsmirigy anyagcseréjét, és súlyosbíthatják a jódhiány hatását. A goitrogének többségének nincs jelentős klinikai hatása, kivéve, ha jódhiány van jelen. A Brassica család zöldségei (azaz brokkoli, káposzta, karfiol, kelkáposzta, fehérrépa, repce) glükozinolátokat tartalmaznak, amelyek erős goitrogén anyagok. A glükozinolátok metabolitjai versenyeznek a jóddal a pajzsmirigy felvételéért. Ennél azonban fontosabbak a természetesen előforduló goitrogének cianoglükozidjai több alapvető élelmiszerben, például manióka, kukorica, bambuszrügy, édesburgonya és lima bab. A cianoglükozidok tiocianátokká metabolizálódnak, amelyek anionok, amelyek versenyeznek a jóddal a pajzsmirigyhormon szintézisében. Számos tanulmány kimutatta, hogy a manióka a jódhiány mellett szerepet játszik az endémiás golyva etiológiájában. A kölesben és a szójában található flavonoidok károsíthatják a TPO aktivitását, ami aggályokat vetett fel a szójaalapú csecsemőtápszereknek a kisgyermekek pajzsmirigy-működésére gyakorolt lehetséges káros hatásai miatt. A szójafogyasztással kapcsolatos klinikai vizsgálatok bizonyítékai azonban továbbra sem meggyőzőek.
NRF2-közvetített génszabályozás és glükóz homeosztázis
Yoko Yagishita,. Masayuki Yamamoto, Molecular Nutrition and Diabetes, 2016
1. Bemutatkozás
Amikor testünk étkezési anyagokat vagy környezeti vegyszereket fogyaszt, a xenobiotikus vegyületeket a sejteken belüli méregtelenítő rendszerek dolgozzák fel. Fontos, hogy a méregtelenítési folyamat során keletkező intermedier metabolitok néha elektrofilek, és gyakran alkotnak adduktokat nukleinsavakkal vagy fehérjékkel. Ezért ezek a köztes metabolitok potenciálisan megzavarhatják a fiziológiai funkciókat. Ezenkívül, ha az étrendi tápanyagok aerob úton metabolizálódnak a sejtek energiatermeléséhez, reaktív oxigénfajok (ROS) keletkeznek, amelyek mérgezőek a testünkre. Így testünk rutinszerűen ki van téve ezeknek a „környezeti stresszoroknak”. Mivel a környezeti stressz később különféle sejtszintű diszfunkciókhoz és betegségekhez vezet, a méregtelenítés és az antioxidatív stressz válaszreakciói elengedhetetlenek testünk egészséges körülmények között történő fenntartásához.
A nukleáris faktorral és az eritroiddal kapcsolatos faktor 2 (NRF2) kritikus szerepet játszik a méregtelenítést és az antioxidatív stresszreakció enzimeket kódoló gének szabályozásában. Az NRF2 hozzájárul testünk védelméhez a környezeti stresszektől. A közelmúltban azt is megállapították, hogy az NRF2 a metabolikus homeosztázis fenntartása érdekében működik. Az NRF2 valóban részt vesz az anyagcsere-rendellenességek patogenezisében; ez a szakasz összefoglalja az e téren a legújabb eredményeket.
Erjesztett tej az elhízás gyulladásos mechanizmusai elleni védelemben
29.2 A funkcionális élelmiszerek fontossága
A funkcionális ételek vagy az egészséges ételek olyan étrendi anyagok, amelyek az alapvető táplálkozáson túl bizonyos egészségügyi előnyökkel járnak. A funkcionális élelmiszerekhez kapcsolódó egészségügyi előnyök a bennük lévő bioaktív komponensektől függenek (Shortt et al., 2004). Körülbelül 8,5% -os éves átlagos növekedési ütem mellett a funkcionális élelmiszerek globális piaca 2020-ra várhatóan meghaladja a 305,4 milliárd dollárt (www.prnewswire.com). Az élelmiszerek funkcionalitása vagy velejárója, vagy beépíthető különféle eszközökkel, például dúsítással, dúsítással, átalakítással és fokozással. Az élelmiszerek funkcionalitását szinte minden élelmiszer-kategóriában fejlesztették vagy javították; ezek közül elsősorban az erjesztett tej (FM) dominál, amely a kereskedelmi piacot uralja. Az FM-ek számos egészséget elősegítő komponenst tartalmaznak, beleértve a hasznos baktériumokat és azok metabolitjait, bioaktív peptidjeiket és az erjedés során kapott egyéb funkcionális molekulákat.
Szója izoflavonok
GENISTEIN ÉS MELLRÁK MODELLEK
2. TÁBLÁZAT Az étrendi genistein hatása az egy patkányra jutó átlagos tumorszámra egy karcinogén által kiváltott emlőrák modellben
| Ellenőrzés | Egyik sem | 8.9 |
| Prepubertal | 1–21 nap | 4.3 |
| Felnőtt | A daganatok megjelenése után (100 nap) | 8.2 |
| Prepubertal + felnőtt | Születéstől a tanulmány végéig | 2.8 |
Megjegyzés: A kontroll AIN76A étrend nem tartalmazott fitoösztrogént. A többi AIN76A diéta testtömeg-kilogrammonként 250 mg genisteint tartalmazott.
a Valamennyi patkányt 80 mg dimetilbenz [a] antracénnel kezelték testtömeg-kilogrammonként a szülés utáni 50. napon.
Forrás: Az adatokat Lamartiniere et al. (2002).
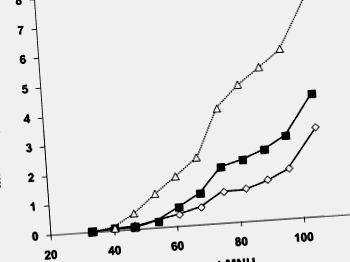
8. ÁBRA . Az étrendi genistein hatása az emlős pletykákra felnőtt nőstény patkányokban, karcinogénnel, N-metil-N-nitrozokarbamiddal kezelt. A kontroll állatokat (nyitott háromszögek) laboratóriumi etetéssel etettük. A genisteint két adagban adták ehhez az étrendhez (200 mg/kg diéta, zárt négyzetek; 2000 mg/kg diéta, nyitott gyémántok).
Hilakivi és mtsai. (1999) kimutatta, hogy a génekhez való prenatális expozíció a patkányokban a DMBA által előidézett emlődaganatok számának növekedésével nőtt. A genisteint azonban iv. és ezáltal megkerülte az anyagcseréjéért felelős enzimeket (lásd az anyagcserét megelőző szakaszokat). Egy későbbi kísérlet során, amikor a genisteint újszülöttesen adták be, Hilakivi és mtsai. (2001) megállapította, hogy az emlődaganatok számának csökkenését okozta, megerősítve Lamartiniere és mtsai korábbi eredményeit. (1995a).
Összegzés: A króm klinikai és táplálkozási jelentősége - 50 év kutatás után is vitatott
A króm táplálékkiegészítőként
A közelmúltban olyan paradigma alakult ki, amelyben ajánlásokat fogalmaznak meg olyan étrendi anyagok bevitelére, amelyek nyilvánvaló egészségügyi előnyeik miatt nem tekinthetők elengedhetetlennek, például az omega-3 zsírsavak a szív- és érrendszer egészségére, valamint a rostok a gyomor-bélrendszer egészségére. Emellett néhány alapvető tápanyagra vonatkozó étrendi beviteli ajánlások készülnek vagy javasoltak, amelyek a látszólagos egészségügyi előnyök miatt jóval meghaladják a hiány patológiájának megelőzéséhez szükséges követelményeket, például kalcium a csontvesztés megelőzésére és a szelén bizonyos típusú rák megelőzésére. Az olyan fogalmak, mint a funkcionális élelmiszerek, a táplálékgyógyszerek és a fitonutriensek, elterjedtek az étrend megbeszélésében az egészség előmozdításában, a hiány patológiájának megelőzésével nem. Így a króm esszenciális bizonyítékainak hiánya nem zárja ki azt az elgondolást, hogy a króm bioaktív elem, és ha fiziológiánál (táplálkozás felett) nagyobb mennyiségben egészítik ki, akkor jótékony hatásai lehetnek. A táplálékkiegészítők által nyújtott ilyen jótékony hatásokra vonatkozó számos állítást Lukaski (4. fejezet) és Lindemann (5. fejezet) ismertet.
Az emberi táplálékkiegészítők által biztosított króm táplálkozáson felüli hatására vonatkozó igények között szerepel a testsúlycsökkentés, a testösszetétel változása (megnövekedett izom és csökkent zsírtömeg) és fokozott fizikai teljesítmény. Lukaski (4. fejezet) jól kontrollált vizsgálatokat ír le, amelyek 200 µg Cr/nap bevitelt mutatnak a viszonylag alacsony krómfogyasztáshoz képest, és nem volt észrevehető hatása a testösszetételre és az izomerőre. Mégis túl korai lehet a króm ergogén segédeszközként való elutasítása a sportolók számára, mert egy tanulmány szerint magasabb dózis (400 µg/nap) javasolt hosszú távú (24 hetes) nagyon nagy intenzitású aerob testmozgással (stresszor, amely növelheti a króm használatát) lásd alább) testzsírvesztést és izomgyarapodást válthat ki [13]. Lukaski (4. fejezet) értékeli azokat a tanulmányokat is, amelyek meghatározzák a króm súlycsökkenésre gyakorolt hatását. A krómot kiváltó súlycsökkenést megállapító tanulmányokat elhomályosította a króm és az energia bevitel ellenőrzésének hiánya, valamint a súlycsökkentés szokatlan mutatójának (testösszetétel-javítási index) alkalmazása. Jól kontrollált, elismert állapotfelmérő intézkedésekkel végzett vizsgálatok azt találták, hogy a táplálékfeletti (200–400 µg/d) króm-kiegészítés elhanyagolható hatással volt a testsúlycsökkentésre vagy a fogyás fenntartására.
Lindemann (5. fejezet) a mezőgazdasági haszonállatokkal kapcsolatos eredményeket a króm esszenciális bizonyítékának lehetséges bizonyítékaként értelmezte. Azt javasolja, hogy stresszhelyzetekben fokozottan szükség van krómra, amelyet nem az étrend biztosít. Ez akkor is bekövetkezik, ha az étrend jelentős mennyiségű krómot tartalmaz, mivel a króm nem túl biológiailag elérhető. A króm biológiailag elérhető szerves formáival történő kiegészítés hatékonyan enyhíti vagy megakadályozza a feltételes krómhiányt. Így értelmezése illeszkedne a táplálkozás szempontjából előnyös vagy feltételesen elengedhetetlen definíciómhoz [14]. Az eredmények másik értelmezése azonban az lehet, hogy a króm szerves formáinak farmakológiai jótékony hatása volt [14]. A króm farmakológiai vagy terápiás hatásainak további tárgyalását az alábbiakban mutatjuk be. Függetlenül attól, hogy tevékenysége alapvető, feltételesen elengedhetetlen, táplálkozás szempontjából előnyös vagy farmakológiailag előnyös, a króm bioaktív hasznos ásványi elemnek tekinthető, különösen bizonyos szerves formákban, mind az állatok, mind az emberek táplálék-kiegészítőkre adott válaszai alapján.
Teratogenezis az állatállományban
Jód - pajzsmirigy
Polifenolok a krónikus májbetegségek, köztük a hepatocelluláris carcinoma kezelésében
Surendra Kumar Shukla, Vijay Kumar, a májbetegség diétás beavatkozásaiban, 2019
Absztrakt
A polifenolok a leggyakoribb bioaktív vegyületek, amelyek jelen vannak a gyümölcsökben, zöldségekben és más növényi eredetű étrendi anyagokban. Erős antioxidáns és gyulladáscsökkentő tulajdonságaiknak köszönhetően a polifenolok védekező hatást mutatnak számos krónikus betegségben. Számos epidemiológiai és preklinikai vizsgálat azt sugallja, hogy az oxidatív stressz és a gyulladás erős szerepet játszik a különböző májbetegségekben. Itt megvitattuk a növényi eredetű polifenolok potenciális szerepét a májbetegségek, köztük a hepatocelluláris carcinoma (HCC) megelőzésében és kezelésében. A különféle májbetegségek közül ez a cikk elsősorban az alkoholmentes zsírmájbetegségre, az alkohol okozta májbetegségekre és a HCC-re összpontosít. Leírtuk a polifenolok biológiai hatását, és megmagyaráztuk ezeknek a bioaktív vegyületeknek a védőhatásaihoz kapcsolódó molekuláris mechanizmusait, amint azt különböző tanulmányok ismertették. Összefoglaltuk ezen bioaktív molekulák megelőző és terápiás szerekként történő alkalmazását a máj különböző betegségei között.
A daganatok metabolikus hatása
Laboratóriumi vizsgálat
A szerotonin és metabolitjainak forgalmának legérzékenyebb mutatója az 5HIAA mérése 24 órás vizeletmintában. Számos diétás anyag zavarhatja az 5HIAA mérését, ezért a vizeletminta begyűjtését megelőzően és annak során három napig kerülni kell (lásd 41.2. Háttérmagyarázat). A teszt nem teljesen specifikus, és negatív eredmény várható nem szekréciós daganatokban és a hátsó bélben szenvedő betegeknél, amelyek nem termelnek 5HT.
A kromogranin A (CgA) egy 48 kDa fehérje, amely neuroendokrin sejtek sűrű magszemcséiben oszlik el, a legmagasabb plazmakoncentrációt a karcinoid tumorokban szenvedő betegeknél észlelik. Beszámoltak arról, hogy a carcinoid szindróma diagnosztizálásakor az érzékenység 75–85%, a specificitás pedig 84–95%. Nem függ a szerotonin szekréciójától, ezért különösen hasznos nem szekréciós vagy atipikus karcinoidokban szenvedő betegeknél, és mivel koncentrációja tükrözi a tumor terheit, markerként használható a kezelésre adott válasz értékelésére. Hamis pozitív eredmények tapasztalhatók máj- és veseelégtelenségben, atrófiás gyomorhurutban, protonpumpa-gátló terápiában és gyulladásos bélbetegségben. A prosztatarák, amely jelentős neuroendokrin komponenst tartalmazhat, mielóma, testmozgás, trauma és magas vérnyomás szintén növelheti a CgA-koncentrációt.
- Fabaceae - áttekintés a ScienceDirect témákról
- CP 55 940 - áttekintés a ScienceDirect témákról
- Zsíros máj - áttekintés a ScienceDirect témákról
- Zsíros hal - áttekintés a ScienceDirect témákról
- Exokrin hasnyálmirigy-elégtelenség - áttekintés a ScienceDirect témákról