Az L5 fehérje kulcsfontosságú a bakteriális 50S riboszomális alegység központi protuberancia in vivo összeállításában
Társított adatok
Absztrakt
Jelen munka során baktériumsejtekbe illeszkedő riboszómákat kaptunk esszenciális riboszomális L5 fehérje hiányában. Az L5 szintézis leállítása után az Escherichia coli sejtek korlátozott számú alkalommal osztódnak. Ez idő alatt a hibás nagy riboszomális alegységek felhalmozódása következik be. Ezekből a 45S részecskékből hiányzik a központi protuberancia (CP) komponensek nagy része (5S rRNS és L5, L16, L18, L25, L27, L31, L33 és L35 fehérjék), és nem képesek társulni a kis riboszomális alegységgel. Ugyanakkor az 5S rRNS megtalálható a citoplazmában az L18 és L25 riboszomális fehérjékkel komplexben, a riboszómák mennyiségével megegyező mennyiségben. Így ez az első bizonyíték arra, hogy az L5 fehérje kulcsszerepet játszik a CP kialakulásában a baktériumsejtben található nagy riboszomális alegység összeszerelése során. Az in vivo CP összeállításának lehetséges modelljét a kapott adatok alapján tárgyaljuk.
BEVEZETÉS
A funkcionálisan aktív bakteriális riboszomális alegységek rekonstrukcióját először több mint 40 évvel ezelőtt hajtották végre sikeresen (1–3), és azóta rengeteg kísérleti adat halmozódott fel in vitro a riboszóma-összeállítással kapcsolatban (4–7). A riboszómák kristályszerkezetei, valamint számos baktérium funkcionális riboszomális komplexeinek szerkezete már elérhető, és betekintést nyújt az összeillesztett riboszóma térbeli szerveződésébe (8–13).
Ebben a munkában megvizsgáltuk az L5 szerepét a riboszóma-összeállításban in vivo. E. coli törzset kaptunk, ahol az r-fehérjét L5 (rplE) kódoló kromoszóma gént inaktiváltuk egy komplementer plazmid jelenlétében, amely indukálható rplE expressziót biztosít. Így az L5 szintézise leállítható az induktor eltávolításával egy növekedési közegből. Az L5-szegény sejtekből származó riboszómák elemzése nagy riboszomális alegységek felhalmozódását mutatta, amelyekből hiányzik a legtöbb CP-komponens. Adataink először bizonyítják, hogy az r-protein L5 kulcsszerepet játszik a bakteriális riboszóma ezen strukturális doménjének kialakulásában in vivo.
ANYAGOK ÉS METÓDUSOK
Törzsek, plazmidok és bakteriológiai technikák
A jelen munkában említett összes törzset és plazmidot az S1 kiegészítő táblázat tartalmazza. A sejteket 37 ° C-on tenyésztettük LB táptalajban és LB-agar lemezeket, kiegészítve (ahol jeleztük) 100 μg/ml ampicillinnel, 20 μg/ml kloramfenikollal és 0,2% (tömeg/térfogat) l-arabinózzal. Az rplE-t kódoló komplementer pNK12 plazmid előállításához a pKAB122 NdeI-EcoRI fragmensét, amely E. coli rplE nyitott leolvasási keretet tartalmaz, klónoztuk a pBADET plazmidba. Ez utóbbi A. Kaliman ajándéka. Ez a pBAD18 (33) származéka, további információkért lásd az S1 kiegészítő táblázatot. Így a pNK12 rplE-t hordoz egy arabinóz által indukálható promoter irányítása alatt, és rezisztenciát biztosít az ampicillinnel szemben. A kromoszomális rplE gén törlését úgy hajtottuk végre, hogy az ΔrplE: cat allélt a KNB219-ből a vad típusú W3110 törzsbe vittük át, amelyet pNK12-vel transzformáltunk, a P1 fág által végzett általános transzdukció útján (34) szerint. A transzduktánsokat klóramfenikollal és arabinózzal kiegészített LB agaron szelektáltuk. Az egyszerűség kedvéért az így kapott törzset MS01-nek hívjuk, vagyis mindig a pNK12 plazmidot tartalmazza.
Sejttenyésztési körülmények
Az L5 fehérje számára kimerült E. coli sejtek előállításához az MS01 törzset 37 ° C-on ampicillinnel és arabinózzal kiegészített LB táptalajban növesztettük A600 ± 0,4-ig. Ezután a sejteket mostuk és beoltottuk 15–20 térfogat előmelegített, 37 ° C-os LB táptalajon, és addig tenyésztettük, amíg a növekedési görbe el nem ért egy fennsíkot (A600 ∼ 0,8–1, 6–8 órán belül). Ez idő alatt a sejttenyészet alikvot részeit vettük a riboszómák ülepedési elemzéséhez. A sejteket összegyűjtöttük, pufferrel (30 mM Tris-HCl, pH 7,5, 200 mM NH4Cl, 10 mM MgCl2, 0,1 mM etilén-diamin-tetraecetsav (EDTA) és 3 mM 2-merkaptoetanol) mostuk, és a (32) szakaszban leírtak szerint tároltuk.
Ugyanezt a stratégiát alkalmazták a kontroll sejtek előállítására. Ebben az esetben azonban az induktor mindig jelen volt a táptalajban, biztosítva az rplE expresszióját transz-ban. A sejteket A600 ∼ 0,8–1 hőmérsékleten gyűjtöttük be.
Riboszómák és riboszomális alegységek elkészítése és elemzése
A riboszómákat a (35) szerint kaptuk, a (32) -ben publikált módosításokkal. A riboszomális alegységek megszerzéséhez az L5-gyel lemerült sejtek riboszómáit 5–20 tömeg% szacharózgradiensekre töltöttük, amelyeket A pufferben készítettünk (10 mM Tris-HCl, pH 7,5, 100 mM NH4Cl, 10 mM MgCl2 és 3). mM 2-merkaptoetanol) és 64 000 g-on és 4 ° C-on 11-12 órán át centrifugáljuk. Ilyen ionos körülmények között ép 50S alegységek maradnak kapcsolatban a 30S alegységekkel 70S riboszómákat képezve, ami nagyban megkönnyíti a 45S részecskék tisztítását. A kontroll sejtekből származó riboszomális alegységeket ugyanúgy készítettük, de 1 mM MgCl2 jelenlétében. A magnéziumkoncentráció 1 mM-ig vagy annál alacsonyabb szintre történő csökkentése egy hagyományos megközelítés, amely lehetővé teszi a 70S riboszómák teljes disszociációját az 50S és 30S alegységekre (35). Az elkülönített alegységeket nagysebességű centrifugálással gyűjtöttük össze, hideg A pufferben oldottuk 10% (térfogat/térfogat) glicerinnel, fagyasztottuk és -70 ° C-on tároltuk. Az L5-szegény sejtekből származó nagy riboszomális alegységeket további centrifugálással tisztítottuk 5–20% (tömeg/tömeg) szacharóz gradiensben.
Az 5S rRNS affinitás-tisztítása az L5-gyel lemerült sejtek citoplazmájából
Az 5S rRNS-t affinitáskromatográfiával izoláltuk L5-Sepharose-on. Az L5 riboszomális fehérjét a korábban leírtak szerint tisztítottuk (42), és kovalensen kapcsoltuk a Sepharose-4B-hez a (43) szerint. A riboszómamentes citoplazmatikus frakciót (S100) pufferban (10 mM Tris-HCl, pH 7,5, 50 mM NH4Cl, 10 mM MgCl2 és 3 mM 2-merkaptoetanol) pufferban inkubáltuk szobahőmérsékleten 30 percig. Ezután a gyantát egymás után mossuk ugyanazzal a pufferrel, amely 50 és 400 mM NH4Cl-ot tartalmaz. Az 5S rRNS-t és a megkötött fehérjéket 3 M NaCl-dal eluáltuk. Az utolsó mosás RNS- és fehérjetartalmát elektroforézissel analizáltuk denaturáló körülmények között, a (39) és (44) pontban leírtaknak megfelelően. A fehérje sávokat ImageJ szoftver segítségével számszerűsítettük. Két olyan fehérjét, amelynek elektroforetikus mobilitása hasonló az 5S rRNS-kötő fehérjékéhez, L18 és L25 eluáltuk a gélről és tömegspektrometriával azonosítottuk.
Eredmények és vita
Az L5-szegény sejtek növekedése és a riboszóma képződése
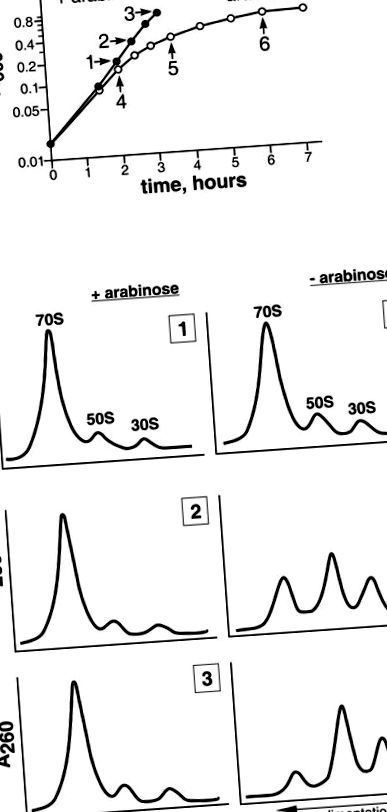
(A) Az MS01 sejtek növekedési görbéi a táptalajban (kitöltött kör) vagy anélkül (kitöltetlen kör) induktorral. A nyilak jelzik azokat az időpontokat, amikor aliquotokat vettek a riboszóma elemzéséhez. A számok (1–6) megfelelnek a B. szakasz riboszomális profiljának. (B) Az MS01-ből származó riboszómák szedimentációs elemzése az induktor jelenlétében (bal oldali panel) vagy hiányában (jobb oldali panel) nőtt fel. A sejt citoplazma komponenseit 5-20% (wt/wt) szacharóz gradiensen végzett centrifugálással frakcionáltuk.
A nagy riboszomális alegységek és az 5S rRNS – fehérje komplex tulajdonságai L5-szegény sejtekből
Az 5S rRNS – fehérje komplex komponensek megoszlása L5-szegény sejtekben. (A) Kis molekulatömegű RNS-ek elektroforetikus elemzése (8% poliakrilamid-gél, 8 M karbamid). 1–5 E. coli rRNS (kontroll); 2 és 3 - S30 frakció a kontroll és az L5-szegény sejtekből; 4. és 5. - S100 frakció a kontroll és L5-szegény sejtekből; 6 és 7 - nagy riboszomális alegységek a kontroll és az L5-gyengített sejtekből. A 2. és 3. sáv hasonló mennyiségű anyagot tartalmaz, ugyanígy a 4. és az 5. sáv is. A 7. sáv kétszer akkora anyaggal van ellátva, mint a 6. sáv.B) Az 5S rRNS-sel az L5-Sepharose-on végzett affinitáskromatográfiával (15% -os nátrium-dodecil-szulfát – poliakrilamid-gél elektroforézis) történő szaporodása. 1 - az L5-szegény sejtek S100 frakciója; 2–3 M sómosás; 3. és 4. — E. coli r-fehérjék L25 és L18.
Az L5 fehérje részvétele a bakteriális riboszóma központi protuberancia kialakulásában
A kontrollból származó nagy riboszomális alegységek fehérje összetétele (A) és L5-kimerült (B) sejteket 2D gélelektroforézissel. Nyilak jelzik az r-fehérjék helyzetét, amelyeket a szöveg tárgyal. A gélek a nagy riboszomális alegységek összes fehérjét tartalmazzák, kivéve az L34 és L36 fehérjéket. Az L34 fehérjét mind a kontroll, mind a 45S részecskékben különböző elválasztási körülmények között találtuk. Az L36 fehérjét nem elemeztük.
(A) Az E. coli riboszóma CP szerkezetének modellje. Az L31 fehérje helyzetét a CP szerkezetében modellezzük, a T. thermophilus riboszómájában elfoglalt helyének megfelelően. A riboszomális fehérjék, az 5S rRNS és a 23S rRNS hélixei vannak feltüntetve. (B) Az L5 fehérje hiányában kialakult bakteriális riboszóma CP régiójának szerkezetére javasolt modell. A modelleket az E. coli és a T. thermophilus riboszómák (PDB 2AW4 és 2J01 bejegyzések) kristályszerkezeteinek felhasználásával állítottuk elő. A modellépítés és a finomítás a Coot program segítségével történt; a kép PyMol segítségével készült.
A CP összeállításának kooperativitása és függetlensége arra utal, hogy nemcsak a riboszóma összeállítása során, hanem a riboszóma működésében is egyetlen szerkezeti egységként jelenik meg. A riboszómában található intermolekuláris keresztkötések alapján az 5S rRNS-t javasolták közvetíteni több riboszomális funkcionális központ között (31). A riboszómaszerkezeti szervezet legfrissebb adatai szerint (9–13) a CP komponensei kölcsönhatásba lépnek egymással, egyidejűleg több komponenssel érintkeznek (4. A ábra). Ezáltal összetett, önálló rendszert alkotnak az 50S alegységen belül, ahol az egyik komponens változásai átadhatók a többieknek. Az összetevők többsége közvetlenül kapcsolatba lép az 5S rRNP-vel, ami megmagyarázza annak fontosságát a CP kialakulásában, és azt sugallja, hogy kulcsszerepet játszik a CP működésében. Ugyanakkor a CP-komponensek közvetlenül érintkeznek a tRNS-ekkel mindhárom riboszomális helyen (L16 és ASF az A-helyen, L5 a P-helyen és L33 az E-helyen); L27 kinyúlik az 50S alegységbe, eljutva a peptidiltranszferáz centrumba; Az L25 a GTPase-társított központ közvetlen közelében található. Erre tekintettel azt javasoljuk, hogy a CP (mint egész) a riboszomális aktív központok működésének koordinátora legyen.
KIEGÉSZÍTŐ ADATOK
Kiegészítő adatok a NAR Online oldalon érhetők el: 1. kiegészítő táblázat.
FINANSZÍROZÁS
Az Orosz Tudományos Akadémia, az Orosz Alapkutatásért Alapítvány; a RAS molekuláris és sejtbiológiai programja. A nyílt hozzáférés díjának finanszírozása: A RAS molekuláris és sejtbiológiai programja.
Összeférhetetlenségi nyilatkozat. Egyik sem nyilatkozott.
- Mugwort pollenhez kapcsolódó élelmiszerallergia lipid transzfer fehérje szenzibilizáció és összefüggés a
- Növényi étrend szempontjai a környezeti hatással, a fehérje minőségével és az edzés teljesítményével kapcsolatban
- Növényi fehérjével kapcsolatos információk; Diagram
- MuscleMeds húsevő marhahús fehérje eper - 56 adag
- Rázza fel. Ezek a legjobban fogyaszthatók fehérje turmixok a súlycsökkentő wellness kapitány számára