Az étkezési zsír erősebben stimulálja a NAFLD fejlődését, mint az étrendi fruktóz Sprague – Dawley patkányokban
Absztrakt
Háttér
Emberi és állatmodellekben az étkezési zsír, a fruktóz és a koleszterin túlzott bevitele összefüggésbe hozható az alkoholmentes zsírmáj betegség (NAFLD) kialakulásával. Az étrendi összetevők egyes szerepei azonban továbbra sem tisztázottak. Ennek további vizsgálatához összehasonlítottuk a magas zsírtartalmú étrend, a magas fruktóztartalmú étrend és a hozzáadott koleszterinnel kombinált étrend hatását a patkányok NAFLD kialakulására.
Mód
Negyven hím Sprague – Dawley patkányt négy csoportba randomizáltunk, vagy kontroll-étrendben (kontroll: 10% zsír); magas zsírtartalmú étrend (HFD: 60% zsír, 20% szénhidrát), magas fruktóz diéta [HFr: 10% zsír, 70% szénhidrát (főleg fruktóz)] vagy magas zsírtartalmú/magas fruktóz-/magas koleszterinszint - étrend (NASH: 40% zsír, 40% szénhidrát (főleg fruktóz), 2% koleszterin) 16 hétig.
Eredmények
16 hét elteltével a máj szövettana kiterjedt steatosist és gyulladást mutatott ki mind a NASH-, mind a HFD-vel táplált patkányokban, míg a HFr-patkányok májváltozása sokkal finomabb volt. Ezeket a megállapításokat a mind a NASH-, mind a máj trigliceridtartalmának szignifikánsan megemelkedetto
Háttér
Az alkoholmentes zsírmájbetegség (NAFLD) egyre gyakoribb májbetegségnek számít, és felvetették, hogy ez a metabolikus szindróma máj megnyilvánulása [1]. Jelenleg a NAFLD járványos arányokat feltételez a világ népességének több mint 25% -át érintve, ami valószínűleg az elhízás és a 2-es típusú cukorbetegség prevalenciájának egyidejű növekedésével függ össze [2], bár a normál testsúlyú egyének egyre nagyobb hányada is érintett a diszlipidémia, mint fontos független kockázati tényező [3]. A NAFLD a májbetegségek széles skáláját jelöli, az egyszerű máj steatosistól kezdve az előrehaladott alkoholmentes steatohepatitisig (NASH), amelyek beavatkozás nélkül átültetést igénylő cirrhosissá és hepatocelluláris carcinomává válhatnak. Míg az egyszerű májsteatózist elsősorban a májsejtek> 5% -ában lévő lipidfelhalmozódás jellemzi, a NASH egy olyan állapot, amelyet tovább lebonyolítanak a lobularis gyulladásos beszivárgások és a ballonosodó hepatocyták jelenléte egyidejű fibrózissal vagy anélkül [4].
Feltételezik, hogy a NAFLD stádiumokon keresztüli progresszió több káros „találatot” is magában foglal, ahol a májgyulladás és az oxidatív stressz egyaránt kulcsfontosságú elősegítő tényező [5]. Ennek megfelelően a proinflammatorikus citokinek, például az alfa-tumor-nekrózis faktor (TNF-α) és a monocita-kemoattraktáns protein-1 (MCP-1) szérum- és májszintjét megnövekedettnek találták mind az egyszerű máj steatosisban, mind a NASH-ban szenvedő betegeknél [6, 7,8,9]. Emellett a glikoproteinek haptoglobinjának és a metalloproteinase 1 szövetgátlóinak (TIMP-1) a NAFLD előrehaladottabb stádiumában lévő betegek plazmájában emelkedettnek bizonyultak, ezért a közelmúltban hasznos klinikai plazma biomarkerekként javasolták őket, jelezve a hepatocita ballonálódását és májfibrózis, illetve [10, 11].
Annak ellenére, hogy a NAFLD specifikus etiológiája továbbra sem világos, az étkezési zsír és a koleszterin mind a máj-, mind az állatmodellekben összefüggésbe hozható a máj steatosisának és a NASH-nak a fejlődésével [12,13,14], újabban pedig az egyszerű szénhidrát fruktóz, mint másik lehetséges járulékos tényező [15, 16]. Az a felismerés, hogy az étrend fontos szerepet játszik a NAFLD patogenezisében, az étrend által kiváltott állatmodellek jelentős sokféleségét eredményezte, ahol a többség (a táplálkozási hiányosságokon alapuló modelleken kívül) a magas zsírtartalmú étrenden alapszik, változó egyszerű szénhidrát és koleszterin [17, 18]. A zsír, a szénhidrátok és a koleszterin egyéni szerepe a NAFLD fejlődésében azonban még mindig nem teljesen világos. Tehát az állatokon végzett vizsgálatok jobb meglátása a zsír, az egyszerű szénhidrátok és a koleszterin egyéni hozzájárulásáról a NAFLD metabolikus és gyulladásos jellemzőihez fontos előfeltétele a betegek összetettségének megértésében. Ezenkívül a NAFLD/NASH állatmodelljeinek felállítása, amelyek jobban utánozzák az emberi patológiát, értékesek lesznek a NAFLD/NASH új terápiáinak tesztelésekor.
A jelen vizsgálat célja ezért az volt, hogy összehasonlítsuk az étrendben magas zsírtartalmú étrend, étkezési fruktóz vagy kombinált étrend hozzáadott koleszterinnel gyakorolt hatásait a NAFLD kialakulására, diszlipidémiára és gyulladásra Sprague – Dawley patkányokban. A NAFLD fejlődését az idők folyamán mind szövettanilag, mind biokémiai szempontból értékelték, és kvantitatív komputertomográfiát (qCT) alkalmaztak a máj steatosisának nem invazív markereként, lehetővé téve a NAFLD progressziójának nyomon követését az egész vizsgálati időszak alatt.
Mód
Állatok
Negyven hím Sprague – Dawley patkányt vásároltunk a Charles River Laboratories-tól (Sulzfeld, Németország). Az állatokat érkezésükkor 2 hétig akklimatizálták, a kísérlet kezdetén 12 hetesek voltak, körülbelül 440–460 g tömegűek. Ketrecenként kettőt tartottak a klórozatlan, nem savas csapvízhez való hozzáféréssel és a kísérlet megkezdéséig korlátlan hozzáféréssel a szokásos rágcsáló-chow-hoz (Altromin 1324, Brogaarden, Dánia). Az állattartó helyiségekben a hőmérsékletet 20–25 ° C-on tartották 12/12 órás világos/sötét ciklus mellett, 30–70% relatív páratartalommal és a levegő változásával 8–15 alkalommal/h.
Kísérleti terv
Plazma minták
Vérmintákat vettek a szublingvális vénából öntudatlan, éheztetés nélküli állatoknál. Ezeket K3-EDTA mikrovetékbe gyűjtöttük, majd centrifugálás után a plazmát elkülönítettük és -20 ° C-on tartottuk a további elemzésig. Triglicerideket (TG), teljes koleszterint (TC), nagy sűrűségű lipoprotein koleszterint (HDL-C), szabad zsírsavakat (FFA), alanin-aminotranszferázt (ALAT), aszpartát-aminotranszferázt (ASAT), Haptoglobint és β-hidroxi-butirátot mértünk. Cobas 6000 c501 műszer (Roche Diagnostics GmbH, D-68296 Mannheim, Németország), a gyártó utasításainak megfelelően. Az MCP-1 és a TIMP-1 plazmaszintjét multiplex esszé alkalmazásával elemeztük (K15179-C1, Mesoscale Discovery, MD, USA).
Ezenkívül plazma mintákat vettünk 4 órás éhgyomri állatoktól a 15. héten (1 héttel a 16. hét előtt vettük őket, hogy elkerüljük az éhgyomort a plazma lipidparamétereinek megsértésével), és megvizsgáltuk endogén inzulinra és glükózra. A vércukorszint-méréshez szükséges mintákat (10 µl) kapilláris csövekbe gyűjtöttük és 500 µL rendszeroldatba helyeztük. A vércukorszintet glükóz-oxidáz módszerrel elemeztük Biosen készülékben (EKF Diagnostics, Barleben, Németország) a gyártó utasításai szerint. Az endogén inzulinméréshez mintákat gyűjtöttünk K3-EDTA mikrovettákba és centrifugálás után; plazmát izoláltunk és elemeztük a korábban leírtak szerint [20]. A leptinszinteket Milliplex assay (RADPKMAG80-K, Merck, Hellerup, DK) alkalmazásával számszerűsítettük.
qMR és qCT
A teljes zsírtömeg meghatározásához minden állatnak 8 és 16 hét elteltével qMR-vizsgálatokat végeztek EchoMRI testösszetétel-analizátorral (EchoMRI, Houston, TX, USA). A zsírszövet tömegmérését a gyártó utasításai szerint és a korábban leírtak szerint végeztük [21].
A NAFLD fejlődésének és progressziójának értékeléséhez qCT-vizsgálatokat alkalmaztak a máj sűrűségének számszerűsítésére, mint a máj zsírtartalmának közvetett mérésére. A máj qCT-vizsgálatát 8 és 16 hét után végezzük izofluránnal altatott patkányokban, Latheta CT-szkennerrel (LCT-200 sorozat, Aloka co. LTD, Tokió, Japán). A máj sűrűségének változásait úgy számítottuk ki, hogy a kiindulási qCT értékeket levontuk a 8. és 16. hét időértékeiből.
Máj biokémia
A máj TG, TC és májglikogén szintjét a bal oldalsó lebenyből vett homogenizált májszöveten Cobas 6000 c501 készülékkel (Roche Diagnostics GmbH 68206 Mannheim, Németország) vettük fel, a gyártó utasításainak megfelelően és az előzőekben leírtak szerint [22].
Szövettan
Gyulladásos markerek a szövetekben
A fentiek szerint a májat, az epididymális zsírraktárakat és a jejunalis szegmenseket az állatok leölése után azonnal kivágtuk és az elemzésig -80 ° C-on tároltuk. A három szövet szövetfehérje-koncentrációját először Pierce BCA Protein Assay Kit (Thermo Fisher Scientific, MA, USA) módszerrel határoztuk meg a gyártó utasításai szerint. A TNF-α és MCP-1 szintet ezután meghatároztuk szöveti homogenizátumokban enzimhez kapcsolt immunszorbens assay (ELISA) készletekkel (AB100785 és AB100778; Abcam, Cambridge, Egyesült Királyság) a gyártó utasításai szerint. Az abszorpciót Spectramax 340PC384 mikrolemez-olvasóval leolvastuk 450 nm-en (Molecular Devices, CA, USA).
Statisztikai analízis
A statisztikai elemzéseket a GraphPad Prism 6.05 verziójával (GraphPad Software Inc., La Jolla, CA, USA) végeztük. Feltételeztük, hogy az adatok normális eloszlásúak, és a qq-diagramok szemrevételezéssel igazolták őket. A normálistól való súlyos eltérések esetén statisztikai elemzéseket végeztek log-transzformált adatokon (természetes logaritmus) vagy nem-parametrikus tesztek alkalmazásával. Az adatokat átlag ± SEM formájában mutatjuk be, kivéve a log-transzformált adatokat, amelyeket geometriai átlagként mutatunk be 95% -os konfidencia intervallummal. Az egyes paraméterek étrendcsoportjai közötti különbségeket egyirányú ANOVA, adott esetben ismételt kétirányú ANOVA vagy Kruskal – Wallis tesztek segítségével elemeztük, és összehasonlítottuk a diétákkal töltött 16 hét után. Bonferroni vagy Dunn korrekciókat alkalmaztunk a többszörös összehasonlítások kiigazításához. Az adatkészletek kiugró értékeit azonosítottuk és eltávolítottuk a GraphPad Prism ROUT-függvényével. p-értékek
Eredmények
A kontroll, a HFD, a HFr és a NASH csoportok kiindulási jellemzőit a 2. táblázat tartalmazza, és azt mutatják, hogy a csoportok a vizsgálat kezdetekor összehasonlíthatók voltak az összes paraméter tekintetében.
Az étrend hatása a testsúlyra, az energiafogyasztásra és a zsíreloszlásra
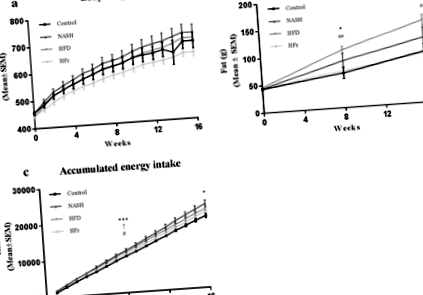
Az 1. ábra a testtömeg, a zsírtömeg és az energiafogyasztás változását mutatja be. A testtömeg a vizsgálat során minden csoportban nőtt, de 16 hét után nem különbözött a kontrolltól (1a. Ábra). A HFD-vel táplált állatokban a zsírtömeg szignifikánsan megnőtt, mind a kontroll, mind a HFr-diétával etetett állatoknál (o 1. ábra
Az étrend hatása a májra
A vizsgálat során a máj sűrűsége (amelyet a máj zsírtartalmának közvetett mércéjeként használtak) qCT-vel mérve mind a négy étrendcsoportban folyamatosan csökkent, a hatás a NASH csoportban volt a legnyilvánvalóbb (2a. Ábra). Mind a 8., mind a 16. héten a máj sűrűségének csökkenése szignifikánsan nagyobb volt a NASH-ban és a HFD-ben a kontrollhoz képest (o 2. ábra
A NASH-val táplált patkányok májja szignifikánsan nagyobb volt a kontrollhoz képest (o 3. táblázat Metabolikus és gyulladásos hatások patkányokban 16 hét után NASH-, HFD- és HFr-diéta után
A májmetszetek szövettani értékelése kontroll-, NASH-, HFD- és HFr-táplált patkányokból. 1. sor: a normál máj reprezentatív H & E-foltjai a Kontroll-táplált patkány és máj steatosis in b NASH-táplált patkány, c HFD-vel táplált patkány és d HFr-vel táplált patkány. A HFD-vel táplált patkányokban a máj steatosisáról szinte kizárólag mikrovezikulárisnak találták (c); HFr-vel táplált patkányokban szinte kizárólag makrovesicularis (d); míg a NASH-val táplált patkányokban a steatosis köztit jelentett a kettő között, mind makro-, mind mikrovezikuláris steatosisban (b). 2. sor: a reprezentatív H&E festett májszakaszok nagyobb nagyítása. e A májmorfológia normálisnak tűnt a kontrolltáplált patkányokban, míg gyulladásos infiltrátumokat figyeltek meg a májból származó májban f NASH-al táplált patkányok, g HFD-vel táplált patkányok és h HFr-vel táplált patkányok 3. sor: Olajvörös O foltok a májszakaszokból j NASH-al táplált patkányok, k HFD-vel táplált patkányok és l A HFr-vel táplált patkányok megerősítették a máj steatosisát b-d. én Olajvörös O-festés a májban a kontrolltáplált patkányból
Az étrend hatása a plazma lipidekre és az általános anyagcsere állapotra
A plazma FFA nem különbözött csoportonként (3. táblázat). A HFr-táplálás jelentősen megnövelte a keringő TG-t, összehasonlítva a Control-, NASH- és HFD-vel (o
Vita
Ez a tanulmány azt mutatja, hogy patkányok táplálása magas zsírtartalmú vagy étrendi fruktóz-étrendben patkányokban kifejezetten eltérő máj-, anyagcsere- és gyulladásprofilt eredményez. Az étkezési zsír és a fruktóz hatásának összehasonlításakor a magas zsírtartalmú táplálás erőteljesebben indukálja a zsírmáj és a kapcsolódó májgyulladás kialakulását anélkül, hogy befolyásolná a keringő lipidkészletet. Ezzel szemben a magas fruktóz tartalmú táplálásnak tűnik a legkifejezettebb hatása a plazma lipidprofiljára, míg a májra csak finom hatások figyelhetők meg. A zsír, a fruktóz és a koleszterin kombinációja súlyosbította és fokozta a májra gyakorolt általános hatásokat. Ennek a vizsgálatnak az erőssége az étrendi zsír (nagyon korlátozott szénhidrátmennyiséggel) és az étkezési fruktóz (nagyon korlátozott zsírmennyiséggel) közvetlen összehasonlítása a NAFLD-vel kapcsolatos paraméterekkel. Ez lehetővé teszi ezen makrotápanyagok betegség előrehaladásában betöltött egyes szerepeinek részletesebb értékelését. Ezenkívül a qCT alkalmazása lehetővé teszi a NAFLD-progresszió non-invazív értékelését a vizsgálat során. Ezt a módszert tudomásunk szerint korábban nem alkalmazták patkányvizsgálatokban, összehasonlítva a NAFLD progresszióját különböző étrendek beadása után.
Az emberek NAFLD-je gyakran elhízással és inzulinrezisztenciával társul, és ezek a metabolikus rendellenességek jobban tükröződtek a HFD-csoportban. Ennek megfelelően csak a HFD-vel táplált patkányok lettek elhízottak, és annak ellenére, hogy ebben a csoportban az összesített energiafelvétel átmenetileg magasabb volt, mint a kontroll állatoknál a 8. héten, az energiafogyasztás különbségei 16 hét után már nem számoltak a HFD által kiváltott elhízással. A keringő leptin szintek szintén csak a HFD-vel táplált patkányokban emelkedtek szignifikánsan, ami a zsírszövet depó méretének növekedését tükrözi ebben a csoportban. Az éhomi hiperglikémia a vizsgálat befejezésekor minden csoportban jelen volt, ami a glükóz anyagcseréjének zavarait jelzi, annak ellenére, hogy az éhomi inzulinszint hasonló maradt a csoportok között. Ezeket a zavarokat tovább erősítette a máj TG emelkedett szintje és a csökkent/változatlan májglikogén, amelyet mind a NASH-, mind a HFD-, mind a HFr-vel táplált patkányokban megfigyeltek, ami szelektív inzulinrezisztenciára utal [23].
A dislipidémia a metabolikus szindróma egyik jellemzője, és kimutatták, hogy szorosan összefügg a NAFLD-vel [36]. A NAFLD-vel társuló diszlipidémiára jellemzően a keringő TG és az alacsony sűrűségű lipoprotein koleszterin (LDL-C) szintjének emelkedése, valamint a csökkent HDL-C szintek [37]. Csak a HFr-diétával táplált patkányokban alakult ki dyslipidaemia, amelyet a hipertrigliceridémia jelenléte határoz meg. Korábbi tanulmányok azt is kimutatták, hogy az étrendi fruktóz viszonylag rövid időn belül potenciálisan növeli a TG-t a plazmában mind patkányokban, mind egerekben [34, 38]. Patkányokban ezt feltételezik részben a fruktóz azon képessége, hogy mind a hiperinsulinémia hiányában fokozza a máj nagyon alacsony sűrűségű lipoprotein (VLDL) -TG szekrécióját, mind pedig csökkenti a keringésből a VLDL-TG clearance-ét. [39, 40]. Mechanikusan a VLDL-TG szekréció növekedését javasolták a fruktóz által kiváltott máj stressz válaszok [40] és a zsírsavak de novo szintézisében részt vevő májenzimek (de novo lipogenezis) együttes hatásának eredményeként [41]. ].
Feltételezik, hogy a fruktóz és a zsír nemcsak a táplálék túlterhelésével, hanem a bélben lévő baktériumok túlnövekedésének stimulálásával is kiválthatja gyulladásos hatásukat a májban, növelve a bél áteresztőképességét, és ezáltal megkönnyítve az endotoxinok transzlokációját a bélgáton, amelyet aztán szállítanak a májba [46, 47]. Jelen tanulmányban egyetlen diéta csoportban sem tudtuk kimutatni a TNF-alfa vagy az MCP-1 megnövekedett bélszintjét. Ezenkívül egyik csoportban sem találtunk megnövekedett MCP-1 és TNF-alfa szintet a zsigeri zsírszövetben, annak ellenére, hogy a gyulladás, különösen a zsírszövet-rekeszben, szorosan összefügg az emberekben a NAFLD/NASH-val [48]. Nevezetesen, ebben a vizsgálatban a citokinanalíziseket epididymális zsírraktárakon végezték, amelyek nem feltétlenül reprezentálják az emberek visceralis zsírszövet-raktárait [49].
Következtetés
Úgy tűnik, hogy az étrendi zsír elsősorban a NAFLD fejlődését hajtja végre Sprague – Dawley patkányokban, erős hatással van a máj zsírfelhalmozódására és gyulladására, míg az étkezési fruktóz elsősorban a keringő lipideket érinti, sokkal finomabb hatással a májra. A zsír, a fruktóz és a koleszterin kombinálása felgyorsítja a NAFLD fejlődését, és növeli a májban észlelt változások súlyosságát.
- Étrendi tényezők az éhomi vércukorszint és a súlygyarapodás esetében Sprague Dawley női patkányokban
- Zsíros máj vacsora ötletek Mit kell enni a NAFLD számára
- Copywriter for Nutritional; Étrend-kiegészítők, az értékesítési példány összeállítása
- Élelmi rost
- Az étrendi halak, mint a súlycsökkentő étrend szérum lipidekre, glükózra és