A személyre szabott mérsékelt edzés hatása a fruktózzal dúsított vízzel táplált Wistar patkányokra
\ \ mathrm (g)> \ szorzata 100 $$Metabolikus mérések
15 órás étkezés nélkül az éhomi glükózt vérben mértük, amelyet egyetlen szúrással gyűjtöttünk a mandibula vénáira (csak egy csepp jött ki) glükométer segítségével (Accu-Chek Performa, Roche, Meylan, Franciaország) [29]. Az orális glükóz tolerancia tesztet (OGTT) 13 hetes korban végezték el, és korábban leírták [11]. Plazmát OGTT vérmintából 2000 g-vel 5 percig végzett centrifugálás után kaptunk. A plazmát ezután lefagyasztották és -80 ° C-on tárolták a további elemzés előtt. Az inzulin koncentrációt ezen plazmamintákon ELISA módszerekkel értékeltük (Rat Insulin Elisa, ALPCO, Eurobio, Courtaboeuf, Franciaország). A glükóz- és inzulinválaszokat AUC-ben fejeztük ki, amelyet trapéz alakú módszerrel számoltunk, és a nettó AUC-t az alapkoncentráció levonása után számoltuk.
Az OGTT és az inzulinkoncentráció eredményei alapján három inzulinrezisztencia és érzékenységi mutatót határoztak meg: az inzulinrezisztencia homeosztatikus modellértékelése (HOMA 2-IR), a máj inzulinrezisztencia indexe (HIRI) és az izom inzulinérzékenységi indexe (MISI). A HOMA 2-IR kiszámítása egy HOMA 2 IR számológép [30] (szoftver elérhető a https://www.dtu.ox.ac.uk/homacalculator, Oxfordi Egyetemen) használatával és OGTT adatok, azaz éhomi inzulinémia és éhomi glikémiával történt. -ban vették t = 0 perc (nagy dózisú glükóz (1 g/ttkg) bevétele előtt. A HIRI a vércukor nettó AUC szorzata, szorozva a plazma inzulin nettó AUC-jával az OGTT első 30 percében. a vércukor-koncentráció bomlási sebessége a csúcsértéktől a mélypontig elosztva az átlagos plazma inzulin-koncentrációval az OGTT alatt [31, 32].
Az adiponektin és a leptin koncentrációit plazmamintákon értékeltük ELISA módszerekkel (Patkány Adiponectin Elisa, ALPCO, valamint „Mouse and Rat Leptin ELISA” BioVendor®, Eurobio, Courtaboeuf, Franciaország). Ezután kiszámították a LAR-t.
Vérbiokémia
A vérkémiai méréseket egy Koné lab 20-on (Thermo Scientific) végeztük, adaptált készlet alkalmazásával: ASpartate AminoTransferase aktivitás (ASAT) (Biomerieux), ALanine AminoTransferase aktivitás (ALAT) (Biomerieux), kreatinin (Jaffé módszer, Fisher Brahms), Albumin ( Bróm-krezol-zöld módszer, Biomerieux), Nem észterezett zsírsav (NEFA) (Wako), TriGliceridek (TG) (PAP módszerek, Biomerieux), összkoleszterin (Koleszterin RTU, Biomerieux). Ezután kiszámolták az ASAT/ALAT arányt. Különböző moláris arányokat számítottak ki a lipidszint-értékelés részeként: NEFA: koleszterin arány [33], NEFA: Albumin arány [34] és koleszterin: TG arány [35]. Az elméleti kreatinin-clearance-et a patkánymodellben már alkalmazott Cockcroft és Gault képlettel [36] számolták ki.
A citrát szintáz (CS) aktivitása
50 mg bal kamrát vagy bal oldali egyetlen oldalt 4 ° C-os Tris HCl-pufferben (0,1 M, pH 8,1) homogenizáltunk Politron alkalmazásával. A homogenátumot ezután összegyűjtöttük és azonnal elemzésre használtuk. A CS aktivitás mérését közvetett módszerrel [28] végeztük 5,5-ditio-bisz-2-nitrobenzoesav (DTNB) felhasználásával. A CS aktivitást így 412 nm-en mértük (Evolution 201, Thermo-Scientific).
Májszövettan
A máj kis adagjaiból mintát vettünk, és azonnal fixáló oldatba (Bouin) tettük legalább 48 órán át. Ezután a mintákat paraffinba ágyazottuk, és 5 μm keresztirányú szeleteket vágtunk és eozin/hematoxylinnel festettünk az esetleges steatosis kimutatása céljából. A steatosis evolúciójának osztályozását a következőképpen határoztuk meg: 0-s pontszám: nincs lipidcsepp, 1-es pontszám: kevesebb, mint 10 mikrovezikulum lipidcsepp, 2-es pontszám: több mint 10 mikrovezikuláris lipidcsepp, 3-as pont: makro- és mikrovezikulumok lipidcseppek> 30, 4. pont: steatosis.
Statisztika
Valamennyi eredményt átlagként ± az átlag standard hibájaként (SEM) fejezzük ki. Az összes statisztikát a Statistica v. 12 szoftverrel (StatSoft, Franciaország) használtuk. A populáció normalitását Shapiro-Wilk teszttel teszteltük. Ezután adaptált teszteket hajtottak végre (Kruskal-Wallis, Mann és Whitney U teszt, kétirányú varianciaanalízis (ANOVA) és ANOVA az ismételt mérésekhez). Az ANOVA-t post-hoc teszt követte (HSD n különféle esetében). Jelentős különbségek (o
Eredmények
Személyre szabott mérsékelt edzés protokoll
A testedzés hatékonyságának értékelése céljából a 4 kísérleti csoportban a mitokondriális tartalom markerként a bal kamra mind a soleus izomában, mind a myocardiumában mértük a CS aktivitás szintjét (1. táblázat). Mindkét szövetben az ET fokozta a CS aktivitást (o 1. táblázat: A citrát szintáz aktivitása két különböző szövetben, 15. héten
A MAS-t rendszeresen mértük képzett állatokon (Ex, ExFF) mind az ET hatékonyságának értékelése, mind az egyéni kiképzés normalizálása érdekében. Az eredményeket a 2. táblázat foglalja össze. A futópad edzés megkezdése előtt mindkét csoportnak (Ex és ExFF, életkor: 9 hét) hasonló MAS értékei vannak: 31,00 ± 0,67 és 29,50 ± 0,83 m/perc. Az Ex csoporton belül a MAS folyamatosan növekszik 12, illetve 14 hetes korban, 3, illetve 5 hét ET után (o 2. táblázat A mérsékelt edzés hatása a MAS-ra (m/perc)
Morfometriai és metabolikus mérések
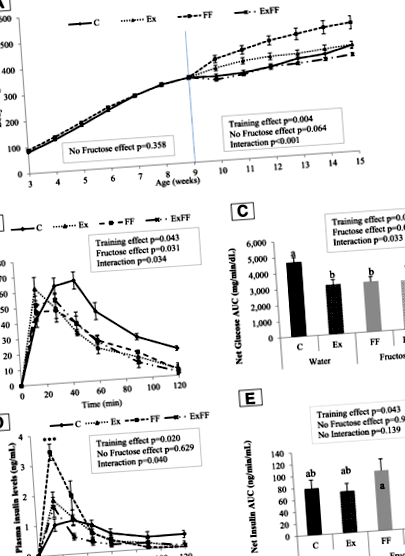
Az 1a. Ábra a kísérleti csoportok testtömeg-alakulását mutatja. A hat első hét során a testsúly hasonló volt a C és az FF között. A 9. hét után az edzés hatása jelentős volt (o = 0,004) és interakciót (fruktózhatás x edzés) figyeltek meg (o 1. ábra
Az OGTT görbék (1b. Ábra) és a nettó glükóz AUC (1c. Ábra) 13 hetes Anova 2 elemzése kimutatta, hogy a fruktózzal dúsított étrend hatással volt a glükózszintre (o = 0,031 és o = 0,026), és az ET analóg hatást váltott ki (o = 0,043 és o = 0,020). Meglepő módon a post-hoc teszt magasabb C-csoport nettó glükóz AUC-értéket mutatott a többihez képest (o 0,001). A leptin, az adiponektin és a LAR tekintetében a fruktóz nem mutatott hatást, és a testmozgás csökkentette plazma szintjüket (o 4. táblázat A mérsékelt testmozgás és a fruktóz kiegészítés hatása a biokémiai vérmarkerekre
Májszövettan
Az ASAT/ALAT arányt (2a. Ábra) jelentősen módosította a fruktózzal dúsított étrend (o = 0,021). A diéta és az ET kölcsönhatása (o 2. ábra
A máj szövődményeinek alakulása. a - Az ASAT/ALAT arány számszerűsítése. C: kontroll (n = 7). Például: gyakorolja a szokásos étrendet (n = 7). FF: fruktóz kiegészítve (n = 8). ExFF: Fruktóz gyakorlat kiegészítve (n = 8). Az értékek átlag ± SEM. Statisztikai különbségek figyelhetők meg kisbetűk (a, b) különbözők. b - A máj hematoxilin- és eozinfestése (× 40 és × 100) egy C-csoport és egy FF-csoport egyik patkányánál. Sávskála = 50 μm. Nyíl = lipidcsepp. Kis lipidcseppek csak az FF csoportban találhatók meg. c - A steatosis evolúciójának osztályozása. A skálát a következőképpen határoztuk meg: 0 pontszám: nincs lipidcsepp. 1. pont: kevesebb, mint 10 mikrovezikulum lipidcsepp. 2. pontszám: több mint 10 mikrovezikuláris lipidcsepp. 3. pont: makro- és mikro-vezikulák lipidcseppjei> 30. 4. pontszám: steatosis. A megfigyelést C (n = 8), Ex (n = 8), FF (n = 8), ExFF (n = 10). Az eredmények megmutatták a patkányok százalékos arányát az egyes pontszámoknál
Vita
Ennek a tanulmánynak az volt a célja, hogy értékelje a személyre szabott mérsékelt ET hatását patkány modellben a fruktóz-kiegészítésre közvetlenül az elválasztás után, különféle paraméterekre, beleértve az anyagcsere-méréseket és a vér biokémiáját.
Korábbi tanulmányok kimutatták, hogy a fruktózban dúsított étrend (20–25% w/v ivóvízben 12 hétig) indukálta a T2D korai stádiumát anélkül, hogy elhízást váltott volna ki Wistar patkányokban [12]. Ugyanezen kiegészítéssel a 21 hétig ez a modell MetS-t indukált steatosis nélkül, és nem mindig T2D-t és elhízást [11]. Ez a tanulmány összhangban áll a fruktózzal dúsított étrendre vonatkozó korábbi eredményeinkkel. 12 hét fruktózzal dúsított étrend után a patkányokban emelkedett éhomi glykaemia (3. táblázat) és IR (HOMA 2-IR> 1,85 mellett), megnövekedett testtömeg (megnövekedett teljes kalóriabevitel mellett) és szívtömeg csak FF-ben alakult ki csoport (3. táblázat). A biokémiai markerek, az elméleti kreatinin clearance, a TG szintek (4. táblázat) és az ASAT/ALAT hányados (2a. Ábra) szintén érintett, máj steatosis nélkül (2b. Ábra, c).
Vizsgálatunk során először a személyre szabott ET hatékonyságát értékeltük, a CS aktivitást használva a mitokondriális tartalom markerként [28, 39]. A két vizsgált izom esetében az edzési protokoll javította a CS aktivitását. Ez összhangban van a korábbi megállapításokkal [40], és bizonyítja edzési protokollunk hatékonyságát (1. táblázat). Ezenkívül a MAS (2. táblázat) minden méréskor javult, diétától függetlenül, ez újabb bizonyíték edzési protokollunk hatékonyságára [28]. Meg kell jegyeznünk, hogy a kontroll patkányokban (Ex csoport: + 52%) nagyobb volt a teljesítmény, mint a fruktózzal kiegészített állatokban (ExFF: + 31%), o
Következtetés
Jelen tanulmány az ET hatását vizsgálta a MetS markerekre. 6 hét után az ET küzdött a fruktózzal dúsított étrend negatív hatásaival. Adataink bizonyítékokat szolgáltattak arra vonatkozóan, hogy az ET csökkentette a testtömeget a fruktózzal táplált patkányokban és javította a glükóz anyagcserét. Valóban, a hiperglikémia és az IR csökkent az inzulin izomérzékenységének fokozásával. Nagyon valószínű volt, hogy az ET hozzájárult a fruktózzal táplált zsírszövet-diszfunkció csökkentéséhez. Mindazonáltal lehetséges, hogy a fruktóz által kiváltott TG de novo szintézis feleslegét az ET nem tudta ellensúlyozni, és hozzájárulna a hipertrigliceridémia fenntartásához. Machado és munkatársai (2017) [70] nemrégiben azt javasolták, hogy az aerob testmozgás gyakorisága és időtartama meghatározó tényező a metabolikus rendellenességek megfordulására a fruktóz-diéta által kiváltott MetS kísérleti modelljében. Eredményeink azt mutatták, hogy a pozitív egészségi hatásokat személyre szabott, mérsékelt, heti 300 perc (1 óra/nap és heti 5 nap) edzéssel értük el 6 héten keresztül. Tehát ésszerű feltételezni, hogy személyre szabott képzésünk időtartamának (6 hét) magasabbnak kell lennie, hogy hangsúlyozza az ET pozitív hatásait.
- Testedzés maximális zsíroxidációs intenzitás mellett túlsúlyos vagy elhízott idősebb nők számára
- A fruktóz és a laktóz elimináló étrend hatása irritábilis bél szindrómában szenvedő betegeknél A
- A nordic walking gyakorlást és módosított étrendet magában foglaló 12 hetes beavatkozások hatása a
- Az alacsony zsírtartalmú tejfogyasztás hatása az almalével és a vízzel az energiafogyasztásra
- Az étrend és a víz rendelkezésre állásának hatása a Rattus norvegicus (Rodentia Muridae) elterjedésére