A citokróm P450 3A gátlása a resveratrol acetoxilezett analógjaival in vitro és in silico modellek
Tárgyak
Absztrakt
Bevezetés
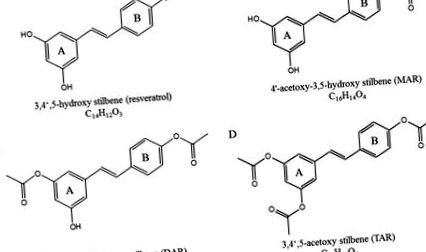
A resveratrol kémiai szerkezete (A), mono-acetoxi-resveratrol (B), di-acetoxi-rezveratrol (C) és tri-acetoxi-rezveratrol (D).
Eredmények
A tesztoszteron metabolizmusa a Caco-2/TC7 sejtvonalban
A tesztoszteron CYP3A4 általi oxidációját követte a maradék tesztoszteron mérése a reakcióközegben a Caco-2/TC7 sejtekkel végzett inkubálás során (2. ábra). A kísérleti körülmények között lineáris reakciósebességet figyeltünk meg az inkubáció első 6 órájában. A tesztoszteront kvantifikáltuk HPLC-analízissel és kalibrációs görbével.
A tesztoszteron metabolizmusa a Caco-2/TC7 sejtvonalban.
Az adatok átlag ± S.E. három ismétlésből.
A CYP3A4 által közvetített tesztoszteron metabolizmus gátlása a Caco-2/TC7 sejtvonalban acetoxi-stilbenének segítségével
A MAR, DAR és TAR hatásait a Caco-2/TC7 sejtek életképességére a leírás szerint mértük. Egyik vegyület sem okozta a Caco-2/TC7 sejtek életképességének csökkenését, ha 100 μM szintig alkalmazták, kivéve a 100 μM TAR-ot, amely a sejtek proliferációjának kisebb mértékű csökkenését okozta (3. ábra). A későbbi kísérletekbe beépítendő legnagyobb koncentrációként a 100 μM koncentrációt választották, figyelembe véve a sejtek életképességének enyhe csökkenését, amelyet a 100 μM TAR okozott.
Caco-2/TC7 sejtek életképessége, ha a tápközegben különböző koncentrációjú mono/di/tri-acetoxi-rezveratrol volt jelen.
A tesztoszteron metabolizmusát a Caco-2/TC7 sejtek tenyészetben alkalmazták az acetoxi-stilbenének és a CYP3A4 kölcsönhatásának tanulmányozására. Az összes vizsgált acetoxi-stilbenén dózisfüggő módon gátolta a tesztoszteron metabolizmusát, szignifikánsan eltér a kontrolltól, és a maximális gátlást 50 μM alkalmazásával érték el (4. ábra). Azonban a TAR volt a leggyengébb gátló képesség az összes vizsgált vegyület közül. Az egyes vegyületek 10 μM alkalmazásának eredményei a kontroll százalékában kifejezve hasonló tendenciát mutattak, amelyben a gátlási kapacitás sorrendje DAR> MAR> TAR volt, a számított arány 45%, 24% és 10% volt., illetve (5. ábra). A resveratrol erősebb gátlási képességet mutatott, mint az összes acetoxi-stilbenén, 10 μM resveratrol 2 óra inkubálás után több mint 80% -kal csökkentette a tesztoszteron enzimatikus oxidációját. Ez a gátlás hasonló volt a CYP 3A jól elismert specifikus inhibitorának, a ketokonazolnál megfigyeltéhez (5. ábra). 2 órás inkubálás után a gátlás mértéke minden kezelésnél csökkent, de még mindig szignifikánsan alacsonyabb volt, mint az egyes inkubációs időpontokban mért kontroll.
A tesztoszteron metabolizmus gátlása a Caco2/TC7 sejtekben különböző koncentrációjú mono-acetoxi-stilbene (A), di-acetoxi-stilbene (B) és tri-acetoxi-stilbene inkubációs idő alatt a kontrollhoz képest. Az adatok átlag ± S.E. három ismétlésből.
A tesztoszteron metabolizmus gátlása a Caco2/TC7 sejtekben az acetoxi-analógok, a resveratrol és a ketokonazol által, 10 μM koncentrációban, az időbeli kontrollokkal összehasonlítva.
A mikroszomális-CYP3A aktivitás gátlása acetoxi-stilen-ben
Az összes vizsgált stilbenénről kimutatták, hogy gátolja a mikroszóma CYP3A aktivitást, amelyet a tesztoszteron [1,2,6,7-3 H (N)] hidroxilezésén keresztül a tríciumos víz felszabadulásának csökkenésében mérnek (6. ábra). A gátlási arányok a kontrollhoz viszonyított százalékban kifejezve azt jelzik, hogy a legerősebb gátlást a ketokonazol alkalmazását követően figyelték meg, amelynek IC50 értéke 14 μM volt. Ebben a rendszerben a rezveratrol IC50-értékét, a koncentráció-válasz görbék alapján becsülve, 28 μM-nek találták. Ebben a rendszerben a MAR, DAR és TAR IC50-értékeit nem lehetett kiszámítani, mivel ezek az anyagok alacsony gátlási szintet okoztak. A TC7 sejtek eredményeivel összhangban a TAR mutatta a legkisebb gátlási képességet, és 10 μM TAR alkalmazása ugyanolyan mértékű gátlást eredményezett, mint a 100 μM. A DAR és a MAR hasonló hatékonyságot mutatott, ha 100 μM koncentrációban alkalmazták, hatásuk (44%, illetve 48% gátlás) hasonló volt a resveratroléhoz (6. ábra).
A tríciumozott víz CYP3A-mediált képződésének gátlása.
Számítási elemzés
Az emberi CYP3A4 (PDB kód: 2V0M) röntgenszerkezetéből levezetett ketokonazol orientációja és maradékkötése modellként szolgált a resveratrol és az itt szintetizált molekulák kölcsönhatásainak kiszámításához. A kiválasztott dokkolási modell alkalmasságának igazolásához először dokkoltuk a ketokonazolt, és gondoskodtunk arról, hogy a CYP3A4 kötőhelyhez való kötődése helyreálljon a kiindulási állapotba, mint az eredeti 2V0M szerkezetben. A ketokonazol-dokkoló szimuláció szerint a kötési hely három fő jellemző alapján írható le: szilárd hidrofób régió, H-kötés donorok/akceptorok és elektrosztatikus kölcsönhatások. A hidrofób klaszter magában foglalja a Leu210, Phe241, Ile301, Ala305 és Leu482 CYP3A4 csoportok alkil és alkil-pi kölcsönhatásait, valamint a ketokonazol molekula klórozott aromás gyűrűjét és imidazol gyűrűjét. A fő H-kötés donor maradék a CYP3A4 Arg372, amely kölcsönhatásba lép a ketokonazol keton oxigénatomjával; míg az Ala370 oxigénatomjai H-kötés akceptorként szolgálnak. A hem-csoport nitrogénatomja további lehorgonyzást biztosít a molekulához annak elektrosztatikus kölcsönhatásai révén (anion-pi) a ketokonazol imidazolgyűrűjével (7A. És 8A., B. Ábra).
A ligandumok dokkolásának eredményei a CYP3A4 kötődési helyén, amelyek mutatják az egymással kölcsönhatásban lévő maradékokat: ketokonazol (A, CDOCKER energia = −40,752 kcal/mol; CDOCKER kölcsönhatás-energia = -60,612 kcal/mol) és resveratrol (B, CDOCKER energia = -25,504 kcal/mol; CDOCKER interakciós energia = −33,960 kcal/mol). A ligandumok szürke pálcikaként, a receptormaradványok pedig zöld pálcikákként vannak feltüntetve. A kötések szaggatott vonalakként vannak feltüntetve, színkódolással az alábbiak szerint: hidrofób kölcsönhatások bíborvörösben, elektrosztatikus kölcsönhatások barnában és hidrogénkötések zöldben.
A hidrofóbitás térképei (A, C) és hidrogénkötések (B, D) a különböző ligandumokhoz kötött CYP3A4 kötődési helyén: ketokonazol (A, B); resveratrol (CD). A ligandumok szürke pálcikaként, a receptormaradványok pedig zöld pálcikákként vannak feltüntetve.
A ligandok dokkolási eredményei a CYP3A4 kötődési helyén, amelyek mutatják az egymással kölcsönhatásban lévő maradékokat: MAR (A, CDOCKER energia = -21,741 kcal/mol; CDOCKER interakciós energia = −29,358 kcal/mol), DAR (B, CDOCKER energia = -25,733 kcal/mol; CDOCKER interakciós energia = -34,376 kcal/mol) és TAR (C, CDOCKER energia = -29,487 kcal/mol; CDOCKER interakciós energia = -36,707 kcal/mol). A ligandumok szürke pálcikaként, a receptormaradványok pedig zöld pálcikákként vannak feltüntetve. A kötések szaggatott vonalakként vannak feltüntetve, színkódolással az alábbiak szerint: hidrofób kölcsönhatások bíborvörösben, elektrosztatikus kölcsönhatások barnában és hidrogénkötések zöldben.
A hidrofóbitás térképei (ÁSZ) és hidrogénkötések (B, D, F) a különböző ligandumokkal dokkolt CYP3A4 kötődési helyén: MAR (A, B), DAR (CD) és a TAR (E, F). A ligandumok szürke pálcikaként, a receptormaradványok pedig zöld pálcikákként vannak feltüntetve.
Vita
A legutóbbi vizsgálatokban bizonyítékok halmozódtak fel arra utalva, hogy a CYP3A4 és az étkezési polifenolok között klinikai jelentőségű kölcsönhatások vannak, köztük flavonoidok, fenolsavak, fenolos alkoholok, stilbenoidok és lignánok 4. A gátló hatásai t-resveratrol a CYP3A4-en, mindkettő in vitro és in vivo, a 15,16,17,18,19,37 irodalomban jól dokumentáltak, és a klinikai vizsgálatok azt találták, hogy a resveratrol beadása számos gyógyszer 20,27 plazmakoncentrációját növeli. Számos QSAR- és farmakofór-leképezési tanulmány rámutat a lipofilicitás fontosságára, valamint a H-kötések szerepére annak meghatározásában, hogy a különféle molekulák milyen kölcsönhatásba lépnek a CYP3A4-gyel 28,29,31,33 .
Egy korábbi tanulmány a molekula lipofilitásának hatását írta le a CYP3A4-gyel való kölcsönhatásaira a resveratrol szintetikus módosításaival. Ez a tanulmány megállapította, hogy a metoxi-stilbenének alacsonyabb az IC50-értéke és nagyobb az affinitása a CYP3A4 iránt, összehasonlítva a szülő resveratrollal és annak glükozidjaival 17. Legutóbbi munkánkból kiderült, hogy egy aldehidcsoport bevitele a resveratrol A gyűrűjébe csökkenti annak képességét, hogy gátolja a CYP3A4-et, amint azt a in vitro és in silico modellek. Ez a megállapítás rávilágít a molekula elektrosztatikus kölcsönhatásainak fontosságára az enzim aktív helyén, a hidrofób és H-kötések mellett 37. A hidroxilcsoporttal ellentétben az acetoxicsoport nagy és erős H-kötés akceptor 39. Így a hidroxilcsoportok fokozatos helyettesítése acetoxicsoportokkal nemcsak növelheti a molekula lipofilitását, hanem H-kötés akceptorokat is bevihet a molekulába. Az acetoxilezett stilbenenek két különböző biológiai modell és szimulációs szoftver segítségével a lipofilicitást különböztették meg a szerkezet-aktivitás viszonyoktól a CYP3A4 gátlásában.
A tesztoszteron CYP3A4 által közvetített metabolizmusát a Caco-2/TC7 sejtek segítségével úgy tervezték, hogy 8 órán át tartson, optimálisan képviselve a belekben való áthaladást. Lineáris görbét figyeltünk meg 2–6 órás inkubációs periódus alatt, ami ennek az időintervallumnak a kiválasztásához vezetett a humán bél CYP3A4 gátlásának vizsgálatához. Figyeltük a szubsztrátfogyasztást, és ebben az összefüggésben a kezelések az összes vizsgált inkubációs periódus alatt szignifikánsan eltértek a kontrolltól. A resveratrol a ketokonazoléhoz hasonló módon gátolta a CYP3A4-et, a számított IC50-értékekkel összhangban a korábbi munkákban bemutatott 16,40,41,42,43 értékekkel. A lipofilicitás növelése a nagyobb gátlás elérése érdekében igaznak bizonyult a MAR DAR-vé történő átalakulásához, de nem a resveratrol MAR-vá történő átalakításához, vagy a további acetilezéshez a TAR-hoz. Valójában nem tudtuk kiszámítani az acetoxi-stilbenbének IC50-értékeit, mivel nem tudtunk elegendő gátlást elérni a TC7 sejtekben vagy az RLM vizsgálatban. A fenti eredmények egyértelműen bizonyítják a strukturális tulajdonságok fontosságát a szorosan kapcsolódó polifenolok CYP3A4 elleni gátló képességének meghatározásában.
Egy nemrégiben készült tanulmány során a ketokonazol, a resveratrol és a resveratrol-aldehid kötőhelyen történő dokkolásának vizsgálata megmutatta a hidrofób és elektrosztatikus kölcsönhatások szerepét a polifenolok és a CYP3A 37 kölcsönhatásaiban. Hasonlóképpen, számítási eszközök szolgálták az élelmiszer-színezékek és az emberi szérumalbumin 44 közötti kölcsönhatások leírását. Itt egy dokkoló szimuláció segítségével megmutattuk, hogy a ketokonazol a hidrogénnel és néhány H-kötéssel való elektrosztatikus kölcsönhatása mellett az aktív helyen erős hidrofób kölcsönhatásokban vesz részt (7A. És 8A., B. Ábra). A CYP3A4-ligand lipofilicitásának fontosságát és hidrofób kölcsönhatások kialakításának képességét jól dokumentálták 4,17,31. A resveratrol kevesebb hidrofób interakcióval rendelkezik, mint a ketokonazol, ami megmagyarázhatja magasabb CDOCKER energiáját. A resveratrolnak azonban erős a hidrofób és elektrosztatikus kölcsönhatása a hemcsoporttal és annak vas/nitrogénatomjaival és H-kötéseivel, több aktív maradékkal, mint a ketokonazol az aktív helyen (7B. És 8C., D. Ábra). A hem-vas szerepe a CYP enzimek metabolikus működési módjában 45,46,47,48, valamint a hemcsoporttal végzett elektrosztatikus kölcsönhatások hozzájárulása a CYP3A4 ligand affinitásához 37 .
Összefoglalva: ez a munka először mutatja be, hogy szimulációs modellek segítségével megjósolható a CYP3A4 aktív helyének szubsztrát által kiváltott módosulása. Ezek az előrejelzések összhangban vannak a bőséges gyógyszer kristályos alkalmazásával elért eredményekkel, pl. eritromicin és kölcsönhatásai a CYP3A4-gyel 49. Valójában a TAR alacsony gátlási képessége mind az emberi sejtvonalban, mind a patkány májmikroszómáiban megmagyarázható ezekkel a szimulációs eredményekkel. Következésképpen az ilyen eredmények egyedülállóan szemléltetik a ligandum és az enzim aktív helye közötti közelség fontosságát. Összességében a szoftveralapú előrejelzések használata, valamint az enzim hatásmódjának és biológiai vizsgálatainak átfogó ismerete lehetővé teszi a komplex enzim-szubsztrát kölcsönhatások mélyebb megértését.
Mód
Szabványok és vegyszerek
t-A reszveratrol (transz-3,4 ′, 5-trihidroxi-sztilben, 99%), tesztoszteron (99%) és ketokonazol (98%) standardokat az izraeli Sigma Aldrich-től vásároltuk. A tesztoszteront [1,2,6,7-3 H (N)] a (Perkin Elmer, USA) cégtől vásárolta. Minden más vegyszert és reagenseket a Sigma Aldrich-től vásároltunk, hacsak másképp nem jelezzük.
A resveratrol acetilezése
A resveratrol acetoxilezett analógjainak szintézisét acetilezési reakciók alkalmazásával hajtottuk végre, amint azt 50 leírja. Resveratrol (0,6 g, 2,63 mmol), acetil-klorid (0,56 ml, 7,88 mmol) és trietelamin (1,009 ml, 7,88 mmol) oldatát 50 ml-es gömblombikban keverjük 20 ml acetonnal. oldószer. Miután az oldatot egy éjszakán át kevertük, megsavanyítottuk (a termékek 1H-NMR- és 13C-NMR-spektrumát 200 MHz-es Bruker NMR spektrométerrel kaptuk (Bruker Biospin GmbH, Rheinstetten, Németország).
NMR elemzés
Mono-acetoxi-resveratrol (MAR)
(4′-acetoxi-3,5-hidroxi-stilbene): 1 H-NMR (200 MHz, MeOD, ppm): 5 2,26 (s, 3H), 6,21 (t, J = 2,2 Hz, 1H), 6,49 (d, J = 2,2 Hz, 2H), 6,99-7,08 (m, 4H), 7,49–7,54 (m, 2H). 13. C-NMR (200 MHz, MeOD, ppm): 8 20,9 (CH3), 103,2, 106,1, 116,5, 122,9, 128,3, 130,2 (CH), 135,1, 136,6, 148,0, 151,6, 159,7, 171,2, 178,2 (C).
Di-acetoxi-rezveratrol (DAR)
(3,4′-acetoxi-5-hidroxi-stilbene): 1 H-NMR (200 MHz, MeOD, ppm): 5 2,27 (s, 6H), 6,45 (t, J = 2,2 Hz: 1 H), 6,78 (q, J = 1,8 Hz, 1 H), 6,86 (t, J = 1,8 Hz, 1 H) 7,04–7,15 (m, 4H), 7,51–7,57 (m, 2H). 13. C-NMR (200 MHz, MeOD, ppm): 8 20,9 (CH3), 109,3, 111,8, 111,9, 124,8, 127,6, 129,2, 129,5 (CH), 136,9, 140,8, 151,7, 153,4, 157,1, 159,6, 171,1 (C).
Tri-acetoxi-rezveratrol (TAR)
(3,4 ', 5-acetoxisztilbene): 1 H-NMR (200 MHz, MeOD, ppm): 5 2,30 (s, 9H), 6,83 (t, J = 2 Hz, 1H), 7,07–7,26 (m, 6H), 7,56–7,61 (m, 2H). 13. C-NMR (200 MHz, MeOD, ppm): 8 20,9 (CH3), 115,7, 118,1, 120,4, 123,1, 128,1, 128,7 (CH), 130,7, 137,7, 151,9, 152,9, 170,7, 171,1, 174,8 (C).
A Caco-2/TC7 sejtek karbantartása
A Caco-2/TC7, a Caco-2 szubklónja magas szintű CYP3A4 enzimet fejez ki, ami meglehetősen gyakori az emberi belekben 51,52,53. A TC7 sejtvonalat általában a CYP3A4 által közvetített metabolizmus tanulmányozására használják 54,55,56. Az ebben a vizsgálatban használt Caco-2/TC7 sejtek Dr. M. Rousset (INSERM U505, Párizs) 52 ajándékai voltak. A kísérlet során ezeket a sejteket aszeptikus körülmények között tartottuk Dulbecco módosított Eagle táptalajában (DMEM) 37 ° C-on, 5% CO2 és 95% levegő mellett. A DMEM-et 20% magzati szarvasmarha-szérummal, 100 egység/ml penicillinnel (Biological Industries, Izrael), 100 μg/ml sztreptomicinnel (Biological Industries), 1% nem esszenciális aminosavoldattal (koncentrált 100X, Biological Industries) és 1% -kal egészítették ki. % L-glutamin oldat (200 mM, Biological Industries). A táptalajt 37 ° C-ra előmelegítettük, mielőtt a sejtekkel érintkeztettük volna. A Caco-2/TC7 sejteket a 25. és a 35. passzázs között alkalmaztuk, és 75 cm 2 -es lombikokban növesztettük. Az új lombikokat 3-4 × 104 sejt/cm 2 koncentrációban oltottuk be .
A tesztoszteron metabolizmusa a Caco-2/TC7 sejtekben
HPLC elemzés
A nagynyomású folyadékkromatográfia (HPLC) elemzését Surveyor HPLC rendszeren (Thermo Finnigan, USA) végeztük, RP-C18 Luna oszlopot használva 250 mm × 4,6 mm × 5 μm (Phenomenex, USA). Az eluálást vízzel (A oldószer) és acetonitrillel (B oldószer) végezzük 0,7 ml/perc áramlási sebességgel. A mobil fázis gradiensét a következőképpen módosítottuk: B A-ban (v/v), 5-25% 5 percig, 25-75% 10 percig, 75-95% 5 percig, majd 2 perc, ismét 5% -ra esett 1 percig, és 4 percig tartott. A mintákat fotodióda-detektorral vizsgáltuk 244 nm-en tesztoszteron és metabolitja, 280 nm-en és 306 nm-en resveratrol és származékai esetében. A csúcsokat 196 és 450 nm között vizsgáltuk.
A sejtek életképességének vizsgálata
Az acetoxi-stilbene analógok hatását a Caco-2/TC7 sejtek szaporodására MTT vizsgálattal értékeltük. A sejteket 96 lyukú lemezekre oltottuk 104 sejt/üreg sűrűséggel, és 24 órán át inkubáltuk. Ezután a sejteket DMEM-rel (kontroll) és a MAR, DAR és TAR acetoxi-stilbene analógokkal kezeltük különböző koncentrációban (5, 10, 25, 50, 100 μM) további 8 órán át. A sejteket 3- (4,5-dimetil-tiazol-2-il) -2,5-difenil-tetrazólium-bromiddal (MTT, 0,5 mg/ml) inkubáltuk 1 órán át, majd 20 percig inkubáltuk DMSO-val. A színezett formazán festék képződését kolorimetriásán értékeltük 550 nm-en, ELX 808 Ultra mikrolemez-olvasóval (BIO-TEK Instruments, London, Egyesült Királyság), KCJunior szoftver segítségével (York, Egyesült Királyság).
Patkány májmikroszómák előállítása
A tesztoszteron metabolizmusa mikroszomális CYP3A által
Számítógépes modellező és szimulációs szoftver
további információ
Hogyan lehet idézni ezt a cikket: Basheer, L. et al. A citokróm P450 3A gátlása a resveratrol acetoxilezett analógjaival in vitro és in silico modellek. Sci. ismétlés. 6., 31557; doi: 10.1038/srep31557 (2016).
- A karbamid transzporter gátlása javítja az urémiás kardiomiopátiát krónikus vesebetegségben - Kuma
- Az indiai körömvirág különböző fajtáinak luteintartalma és in vitro antioxidáns aktivitása
- Hogyan készüljünk fel a műtrágyázásra 13 lépés
- Húsanalógok A minőség javításának „nagy lehetősége”
- In vitro vizsgálat megmutatja a ketogén étrend pozitív hatásait a mitokondriális működésre Leigh-szindrómában