A bélhormonok jövőbeli szerepe az elhízás kezelésében
Rachel C. Troke
Nyomozó Orvostudományi Tanszék, Diabetes, Endokrinológia és Metabolizmus Osztály, Imperial College London, London, Egyesült Királyság
Tricia M. Tan
Nyomozó Orvostudományi Tanszék, Diabetes, Endokrinológia és Metabolizmus Osztály, Imperial College London, London, Egyesült Királyság
Steve R. Bloom
Nyomozó Orvostudományi Tanszék, Cukorbetegség, Endokrinológia és Metabolizmus Osztály, Imperial College London, 6. emelet, Commonwealth Building, London W12 0HS, Egyesült Királyság
Absztrakt
Az elhízás-járvány jelentős terhet jelent mind az egészségügyi, mind a gazdasági eredmények szempontjából, és a jelenlegi orvosi terápiák nem elegendőek ennek a kihívásnak a kezeléséhez. A bariatrikus műtét az egyetlen olyan elhízás kezelésére rendelkezésre álló terápia, amely hosszú távú, tartós fogyást eredményez. Úgy gondolják, hogy ennek a műtétnek a kedvező hatásai - legalábbis részben - a bélhormonok, például a GLP-1, PYY, PP és az oxyntomodulin változásai révén következnek be, amelyek az eljárást követik. Ezek a hormonok később vonzó új célpontokká váltak az elhízási terápiák fejlesztése szempontjából. Itt áttekintjük ezen bélpeptidek fejlődését, mint jelenlegi és új terápiákat az elhízás kezelésében.
Háttér
A jelenlegi elhízási járvány nagy kihívást jelent az egészségügyi szolgáltatók számára. Az Egészségügyi Világszervezet (WHO) globális statisztikája szerint 2008-ban a férfiak 10% -át és a nők 14% -át kövérnek, a felnőttek további 35% -át pedig túlsúlyosnak sorolták [WHO, 2012]. Ez a probléma a nyugati országokban eltúlzott és 2011-re csak Angliában a túlsúly és az elhízás aránya a férfiak 65% -ára, a nők 58% -ára nőtt [Health and Social Care Information Center, 2013]. Ez a növekvő elhízási járvány óriási terhet jelent mind az egészségügyi, mind a gazdasági eredmények szempontjából. 2007-ben az NHS költségei, amelyek közvetlenül a túlsúlynak és az elhízásnak tudhatók be, 4,2 milliárd fontot tettek ki [Swanton, 2008], és az előrejelzések szerint 2025-re 8,3 milliárd fontra emelkednek, elérve az NHS teljes költségvetésének csaknem 12% -át [Foresight, 2007]. Ezenkívül az elhízás számos más egészségügyi állapot, köztük a 2-es típusú cukorbetegség, az iszkémiás szívbetegségek, agyvérzés és a rák fontos kockázati tényezője, és mind az összes ok, mind az ok-specifikus halálozás fokozott kockázatát hordozza magában [Ringbäck Weitoft et al. 2008; Whitlock és mtsai. 2009; Zheng és mtsai. 2011].
Az elhízás e növekvő hullámával szemben hatékony orvosi kezelési stratégiákra van szükség. A terápiás lehetőségek, különösen az orvosi terápiák, azonban korlátozottak. Az életmód és az étrend módosítása önmagában, bár kezdetben ígéretes, az elhízott egyének többsége számára nem nyújt hosszú távú kezelési lehetőséget. Az Orlistat az egyetlen engedélyezett orvosi kezelés az elhízás kezelésére az Egyesült Királyságban. Ez egy hasnyálmirigy-lipáz gátló, amely megakadályozza a zsír felszívódását, de csak szerény, 2,9 kg-os fogyást ér el a placebóval összehasonlítva [Rucker és mtsai. 2007]. A korábban elhízásra engedélyezett terápiákat, például a sibutramint és a rimonabant, a szív- és érrendszeri, illetve a pszichiátriai egészséggel kapcsolatos aggályok miatt visszavonták [Christensen és mtsai. 2007; James és mtsai. 2010].
A sikeres elhízáskezelés jelenleg a bariatrikus műtétekre korlátozódik. Ez az egyetlen terápia, amely kimutatta a tartós, hosszú távú fogyás előidézésének képességét, valamint a mortalitás és a morbiditás csökkenését [Sjostrom et al. 2007]. A leggyakoribb bariatrikus eljárás a Roux-en-Y gyomor bypass (RYGB), amely az összes testsúlycsökkentési műtét 75% -át teszi ki [Smith et al. 2008]. Ma már jól bebizonyosodott, hogy a gyomor megkerülését követően megváltozik a különböző bélhormonok szekréciója, ami az étvágyhoz és a jóllakottsághoz, valamint az energiafelhasználáshoz kapcsolódik [Beckman és mtsai. 2011; Le Roux és mtsai. 2006, 2007; Pournaras et al. 2010]. Úgy gondolják, hogy ezek a változások hozzájárulnak a RYGB után megfigyelt kiemelkedő súlycsökkenéshez és a vércukorszint javulásához. Ezek a megállapítások arra a felvetésre vezettek, hogy a bélhormonok az új elhízás és a cukorbetegség terápiáinak célpontjai lehetnek, és ezek a peptidek később nagy érdeklődést mutatnak.
Bél hormonok
Peptid YY
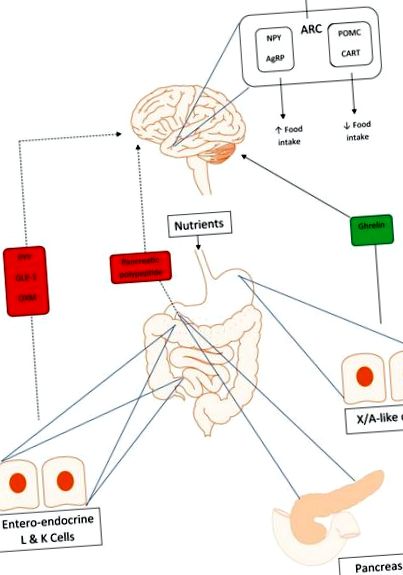
Az YY peptid (PYY) egy 36 aminosavból álló peptid, amely szájon át történő tápanyagterhelésre válaszul a distalis bél entero-endokrin L-sejtjeiből választódik ki (1. ábra). A PYY a peptidek „PP-szeres” családjába tartozik, amely magában foglalja a hasnyálmirigy-polipeptidet (PP) és az Y-neuropeptidet (NPY). Azért nevezik őket, mert harmadlagos szerkezetük hajtűszerű U alakú hajtást képez.
A bél-agy tengely kölcsönhatásai. A folytonos vonal pozitív visszajelzést, a szaggatott vonal pedig negatív visszajelzést jelez. Az YY peptid (PYY), a glukagon-szerű peptid-1 (GLP-1) és az oxyntomodulin (OXM) negatív visszajelzést adnak a hipotalamuszban az étvágyat szabályozó területekre az orális tápanyagterhelés érzékelésével kapcsolatban. A hasnyálmirigy-szigetekből származó hasnyálmirigy-polipeptid (PP) szintén anorektikus, a hipotalamuszban található központi étvágyközpontokon keresztül jelez. A Ghrelin orexigén, pozitív visszajelzést ad a hipotalamusz magjaihoz, és aktiválja az Y neuropeptid (NPY) és az agouti-rokon peptid (AgRP) neuronokat az élelmiszer-bevitel növelése érdekében.
A PYY-szekréciót az összes tápanyag bevitele stimulálja, azonban a vélemények eltérnek arról, hogy melyik makroelem táplálja a PYY-felszabadulás legnagyobb stimulációját. A rágcsálóknál úgy tűnik, hogy a fehérje biztosítja a legerősebb ingert a felszabaduláshoz [Batterham et al. 2006], míg a magas szénhidráttartalmú és alacsony zsírtartalmú étrend kimutatták, hogy az elhízott embereknél a legmagasabb szintet adja [Essah et al. 2007]. Érdekes módon a PYY szintje körülbelül 15 percen belül emelkedni kezd minden kalóriabevitel után [Gibbons et al. 2013], még jóval azelőtt, hogy maguk a tápanyagok eljutnának a disztális bélbe, más idegi vagy hormonális mechanizmusokra utalva a felszabaduláshoz. PYY1-36 néven szekretálódik, majd a DPP-4 enzim hasítja az aktív PYY3-36 formát. A PYY, más bélhormonokkal, mint például az oxyntomodulin (OXM) és a glukagon-szerű peptid-1 (GLP-1), megnövekedett étkezés utáni szintet mutat gyomor bypass műtéten átesett alanyokban [Borg et al. 2006; Laferrère és mtsai. 2010; Le Roux és mtsai. 2006]. Úgy gondolják, hogy a PYY emelése legalább részben felelős az ebben a betegcsoportban tapasztalható markáns és tartós fogyásért.
Hasnyálmirigy-polipeptid
A PP ugyanahhoz a „PP fold” peptidcsaládhoz tartozik, mint a PYY. A PYY-hez hasonlóan ez is egy 36 aminosav-peptid, amelyet étkezés után állítanak elő. Míg azonban a PYY a distalis bélben lévő entero-endokrin L-sejtekből származik, a PP-t a hasnyálmirigyben található Langerhans-szigetek PP-sejtjei választják ki (1. ábra) [Adrian et al. 1976; Larsson és mtsai. 1975]. A PYY-hez hasonlóan elhízott egyéneknél a PP-szint csökken, és étkezés után kisebb emelkedést mutat [Marco et al. 1980].
Ismert, hogy a PP csökkenti a rágcsálók táplálékfelvételét [Asakawa et al. 2003b], normál testsúlyú emberi alanyokban [Asakawa et al. 2006; Batterham és mtsai. 2003a; Jesudason és mtsai. 2007] és Prader – Willi-szindrómában, elhízás és hiperfágia által jellemzett állapotban [Berntson és mtsai. 1993]. A PP nagy affinitással rendelkezik az Y4 receptorok iránt, amely az NPY receptor egyik altípusa, amely széles körben megtalálható az agyban, beleértve a hipotalamuszt és az agytörzset is, amelyek kulcsfontosságúak az étvágy központi kontrolljában [Parker és Herzog, 1999]. A PP hatásának ezen központi mechanizmusának fontosságát támasztja alá az a tény, hogy a hipotalamusz Y4 receptor delécióval rendelkező egerekben a PP nem tudta kiváltani a c-fos aktivációt (a neuronok aktivációjának markere) [Lin és mtsai. 2009].
A táplálékfelvétel csökkentése mellett a PP a gyomor ürítését is csökkenti [Asakawa et al. 2003b; Schmidt és mtsai. 2005], amely potenciálisan visszajelzést ad a központi jóllakottsági központoknak a vagus idegen keresztül. A vagális afferens jeleket evéskor a gyomorfeszülés szakaszos receptorai váltják ki a gyomorban [Wang et al. 2008]. Érdekes, hogy Asakawa és munkatársai, valamint a gyomor ürítésének csökkenését demonstrálták, hogy a vagotomia gyengítette a PP gátló hatását az étel bevitelére. Ez bizonyítékot szolgáltat arra, hogy jóllakottságának legalább egy része vagálisan közvetített, esetleg gyomorfeszüléssel, de potenciálisan a vagális afferensek PP-receptorain keresztül is, amelyek az agytörzs és a hipotalamusz jóllakottsági központjainak jelzik [Asakawa et al. 2003b]. Ugyanez a csoport feltételezi az EE növekedését a PP által. Az EE növekedése és a táplálékfogyasztás csökkenése fokozná a súlycsökkenést, amelyet a PP elhízott alanyoknak történő beadása okoz [Asakawa et al. 2003b], vonzó lehetőségsé téve ezt az elhízás terápiájaként.
A PP-alapú terápia egyetlen klinikai vizsgálata tehát Bloom és a fent említett kollégák által végzett vizsgálat [Tan és mtsai. 2012]. Bármely más adatot a PP emberben történő felhasználásáról a natív peptid és a benne rejlő rövid t1/2 felhasználásával állítottak elő. További in vivo vizsgálatokra van szükség a PP módosított formáinak alkalmazásával annak teljes elhízás elleni potenciáljának értékeléséhez.
Glükagonszerű peptid-1
A GLP-1 egy peptidhormon, amely inkretinként működik, serkenti az inzulin felszabadulását a hasnyálmirigy β sejtjeiből, válaszul az orális tápanyagterhelésre. A GLP-1 főleg a vékonybélben lévő entero-endokrin L-sejtekből szabadul fel (1. ábra) [Herrmann és mtsai. 1995]. A glukagon prekurzor, a proglukagon transzláció utáni feldolgozásának terméke [Orskov et al. 1989].
A GLP-1-nek két fő biológiailag aktív formája van, a GLP-1 (7-36) amid és a GLP-1 (7-37), az uralkodó a GLP-1 (7-36) amid. A GLP-1 in vivo gyorsan lebomlik a dipeptidil-peptidáz-4 (DPP-4) enzim által inaktív metabolitokká, ezért rövid a keringése a t1/2-vel, ami miatt a natív GLP-1 terápiás alkalmazásra alkalmatlanná válik. A GLP-1 különálló receptorán, egy G-fehérjéhez kapcsolt receptoron keresztül hat, amelynek változatos szöveteloszlása van az emberekben. Többek között a hasnyálmirigyben, a bélben és az agyban találhatók GLP-1 receptorok, különösen a hipotalamusz, az NTS és a területi postrema (AP), amelyek mind szorosan kapcsolódnak az étvágyszabályozáshoz [Merchenthaler et al. 1999]. Az inkretin hatása mellett a GLP-1 hatása magában foglalja a hasnyálmirigy α sejtjeiből származó glukagon szekréciójának elnyomását [Creutzfeldt és mtsai. 1996], késleltetve a gyomor kiürülését [Schirra és mtsai. 2006], és az étvágy elnyomása [Punjabi et al. 2011].
A GLP-1 jelenleg a legsikeresebb bélhormon, amelyet emberben terápiás célokra lehet kiaknázni. 2-es típusú cukorbetegség kezelésére használják inkretin hatása miatt, és napjainkig számos készítmény áll rendelkezésre. Az első gyógyszerként kifejlesztett molekula az exenatid (Byetta®) volt. Először az Egyesült Államok Élelmiszer- és Gyógyszerügyi Hivatala (FDA) hagyta jóvá 2005-ben, és a Gila Monster Heloderma suspectum gyík nyálából származott. Az emberi GLP-1-rel csak 53% -ban homológ. Míg kötődik a GLP-1 receptorhoz, ellenáll a DPP-4 által történő lebomlásnak, meghosszabbítja a t1/2-t és lehetővé teszi a napi kétszeri injekciót [Robles és Singh-Franco, 2009]. Ezt követően a GL1-1 más manipulációit hajtották végre a t1/2 meghosszabbítása és az elfogadhatóbb injekciós ütemterv biztosítása érdekében. A liraglutidot (Victoza®) az exenatid naponta egyszeri injekciójának alternatívájaként fejlesztették ki. A liraglutid sokkal közelebbi homológiát mutat (97%) az emberi GLP-1-hez, de módosult egy 16 szénatomos zsírsavlánc hozzáadásával, amely lehetővé teszi az albuminnal való kötődést [Sisson, 2011]. Ez tagadja a lebontást és a kiürülést, és lehetővé teszi a napi egyszeri kívánatosabb beadást. Fej-fej vizsgálatban a liraglutid jobban teljesített, mint az exenatid a glikémiás javulás szempontjából, de a testtömeg-csökkenés mértéke mindkét csoportban hasonló volt,
A közelmúltban aggályok merültek fel a GLP-1 receptor agonisták biztonságosságával kapcsolatban. Javasoljuk, hogy mind a DPP-4 inhibitorok (amelyek megakadályozzák a GLP-1 lebomlását), mind a GLP-1 receptor agonisták növeljék a hasnyálmirigy-gyulladás, a hasnyálmirigyrák, az exokrin hasnyálmirigy hiperpláziája és a pajzsmirigy C-sejtjeinek potenciális kockázatát. a medulláris pajzsmirigyrák elődje [Butler és mtsai. 2013]. Ezeket a megállapításokat azonban továbbra is vizsgálják, és az ok-okozati összefüggésre vonatkozóan még nem vontak le következtetést. Ezen szerek alkalmazásának kockázat-haszon arányát is figyelembe kell venni [Nauck, 2013].
Oxyntomodulin
Az OXM, egy 37 aminosav-peptid hormon, a GLP-1-hez hasonlóan, a proglukagon transzláció utáni feldolgozásából származik. Étkezés hatására GLP-1-vel választják ki az entero-endokrin L-sejtekből (1. ábra). Az OXM kötődik mind a GLP-1, mind a glükagon receptorokhoz, de valószínűnek tűnik, hogy az étvágyra gyakorolt hatásának nagy részét a GLP-1 receptoron keresztül fejti ki, mivel egy GLP-1 receptor antagonista együttes adása blokkolja az OXM anorektikus hatásait [ Dakin és mtsai. 2001].
Kimutatták, hogy az OXM gátolja mind a gyomorsav-szekréciót, mind a hasnyálmirigy-enzim szekrécióját, az intravénás beadást követően késlelteti a gyomorürülést [Schjoldager et al. 1989]. Patkányokon perifériásan bebizonyosodott, hogy az OXM jelentősen csökkenti a táplálékfelvételt, valamint csökkenti a testtömeg-gyarapodást párokkal etetett állatokhoz képest [Dakin et al. 2004]. Mivel a páros táplálékkal kezelt és kezelt csoportok azonos mennyiségű ételt kapnak, az OXM-mel kezelt csoportnak a csökkent táplálékfelvételtől eltekintve további ösztönzést kell adnia a fogyáshoz. Mindkét állatcsoport zsírpárnáinak vizsgálatakor az OXM-kezelt patkányokban a zsírpárna súlya alacsonyabb volt. Ez azt javasolta, hogy az EE növekedése legyen a súlycsökkenés további ösztönzője, az OXM csoport a zsírraktárakat használja fel energiaszubsztrátként. Kimutatták, hogy az OXM növeli az EE-t [Dakin és mtsai. 2002; Wynne és mtsai. 2006], amelyet a tevékenységhez kapcsolódó EE növekedése látszik közvetíteni. Nemrégiben kimutattuk, hogy az exogén módon beadott glukagon megbízhatóan növeli a pihenő EE-t [Tan és mtsai. 2013] Mivel az OXM kettős hatást fejt ki mind a glukagon, mind a GLP-1 receptorokon, valószínű, hogy hatásait az EE-re a glükagon receptor révén fejti ki.
Az OCM központilag az ARC-be injektálva tartósan gátolja a táplálékfelvételt [Dakin és mtsai. 2004]. Beszámoltak arról, hogy egészséges OXM intravénás infúziója egészséges emberi önkéntesekben csökkenti az élelmiszer-bevitelt [Cohen és mtsai. 2003] mind az infúzió alatt, mind az infúzió befejezését követő 12 órán belül. Ezenkívül az OXM szubkután önadagolása 4 hetes időszak alatt 2,4% -kal csökkentette a testsúlyt, és csökkentette a táplálékfelvételt a túlsúlyos és elhízott önkénteseknél [Wynne et al. 2005].
Ghrelin
A ghrelin az egyetlen ismert orexigén hormon, és ha sovány és elhízott emberi önkénteseknek is beadják, növeli a táplálékfelvételt [Druce et al. 2005, 2006]. Ez egy 28 aminosav-peptid, amelyet a gyomor fundusában X/A-szerű sejtekből választanak ki (1. ábra), és éhomi állapotban a legmagasabb, szintje étkezés után csökken. A ghrelin két fő formában létezik: inaktív, nonacilezett formában és az aktív, acilezett formában, amelyet nemacilezett ghrelinből alakítanak át a Ghrelin O-aciltranszferáz (GOAT) enzim. A PP, PYY és más bélhormonokhoz hasonlóan a ghrelinnek is vannak receptorai a hipotalamuszban, amelyek hozzájárulhatnak az étvágyra gyakorolt hatásához [Mondal és mtsai. 2005; Willesen és mtsai. 1999]. Az acil-ghrelin, az aktív forma, ismerten csökkenti az inzulin szekrécióját [Tong és mtsai. 2013]
Érdekes módon az étkezés utáni ghrelin szuppresszió nem volt összefüggésben a vagális jelzéssel, de az éhgyomri állapotban látható ghrelin emelkedést a subdiaphragmatikus vagotomia teljesen megszüntette [Williams és mtsai. 2003], ami azt sugallja, hogy az étvágycsökkentés a hipotalamuszon keresztül történő közvetítés mellett más utakon is szabályozható.
Kombinált terápiák
Az ígéretes eredmények ellenére, ha ezek közül a bélhormonok közül néhány monoterápiás, valóban meg akarjuk ismételni a bélhormon-változásokat a bariatrikus műtét után, akkor jobb eredményeket lehet elérni egynél több hormon hatásának kombinálásával. 2005-ben Neary és munkatársai kimutatták, hogy a PYY és a GLP-1 additív hatást gyakorol a táplálékfelvételre, mind perifériás egerekben történő beadás esetén, mind az ember intravénás infúzióját követően [Neary és mtsai. 2005]. Ugyanez a csoport ezt követően vizsgálta a PP és a PYY kombinációját, azonban e két hormon kombinációja nem volt előnyös önmagában bármelyik peptiddel szemben, ha egerekben vagy emberekben adták [Neary és mtsai. 2008]. A PYY és az OXM kombinációja hat az NPY receptorokra, valamint a GLP-1 és a glukagon receptorokra, és ez a kombináció az ételfogyasztás csökkenését is mutatja, bármelyik hormon önmagában [Field et al. 2010]. Ezenkívül nem szabad megfeledkeznünk a GLP-1 és a glukagon fentiekben leírt kettős agonista hatásáról [Day et al. 2009; Pocai és mtsai. 2009]. A fent leírt hormonok kettős vagy akár hármas agonistáinak használata kulcsot jelenthet a testsúlycsökkenés maximalizálásához és az optimális elhízáskezelés kialakításához.
Következtetés
Az elhízás globális problémájának kezelése érdekében új kezelési lehetőségeket kell kidolgozni a műtőn kívül. A jóllakottság növelésével, az étvágy csökkentésével és az energiatermelés növekedésének ösztönzésével elő kell mozdítaniuk az energiafogyasztás és a ráfordítás egyensúlyának változását. A bélhormonok tulajdonságai, valamint az EE-re és a bevitelre gyakorolt ismert hatásaik megfelelnek ezeknek a kritériumoknak, és elsődleges célpontokká teszik őket az új elhízási terápiák kifejlesztésében.
Lábjegyzetek
Finanszírozás: A szakaszt az MRC, a BBSRC, az NIHR támogatásai, az Integratív Emlősök Biológiai (IMB) kapacitásépítési díja, az FP7- EGÉSZSÉG- 2009- 241592 EuroCHIP támogatása finanszírozza, és az NIHR Imperial Biomedical Research Center finanszírozási rendszere támogatja. R.C.T. az MRC Klinikai Kutatási Ösztöndíja támogatja. T.M.T. az MRC támogatásai támogatják. S.R.B. az NIHR Senior Investigator Award és az MRC támogatja.
Összeférhetetlenségi nyilatkozat: A szerzők nem jelentenek összeférhetetlenséget a cikk elkészítése során.
Közreműködői információk
Rachel C. Troke, Nyomozó Orvostudományi Tanszék, Cukorbetegség, Endokrinológia és Metabolizmus Osztály, Imperial College London, London, Egyesült Királyság.
Tricia M. Tan, Investigatív Orvostudományi Tanszék, Cukorbetegség, Endokrinológia és Metabolizmus Osztály, Imperial College London, London, Egyesült Királyság.
Steve R. Bloom, Nyomozó Orvostudományi Tanszék, Cukorbetegség, Endokrinológia és Metabolizmus Osztály, Imperial College London, 6. emelet, Commonwealth Building, London W12 0HS, Egyesült Királyság.
- A szimpatikus idegrendszer és az elhízás szerepe az etiológiában és a kezelésben - Snitker - 2000 -
- A fogászat szerepe az elhízás kezelésében - áttekintés - ScienceDirect
- A drogok felhasználása az elhízás kezelésében A táplálkozás éves áttekintése
- A metformin alkalmazása a gyermekkori elhízás kezelésében - Teljes szöveg nézet
- A hagyományos kínai orvoslásban használt mennydörgés isten szőlő potenciális elhízási kezelés -