Egy regény MFSD8 mutáció egy 7-es típusú neuronális ceroid lipofuscinosisban szenvedő orosz betegben: esetjelentés
Absztrakt
Háttér
A neuronális ceroid lipofuscinosisok (NCL) a leggyakoribb autoszomális recesszív neurodegeneratív rendellenességek gyermekeknél. A klinikai megnyilvánulások közé tartozik a progresszív kognitív hanyatlás, motoros károsodás, ataxia, látásvesztés, rohamok és korai halál. A mai napig több mint 440 NCL-t okozó mutáció ismert 13 génben.
Eset bemutatása
Egy 7 éves ceroid lipofuscinosis (NCL7) által érintett 5 éves lány klinikai és genetikai jellemzőiről számolunk be. 2,5 éves kora óta progresszív motoros és mentális romlása volt. Később progresszív látásvesztés, sztereotípiák, akciós myoclonus és epilepszia alakult ki nála. 5 éves korára abbahagyta a járást. A tünetek alapján a Rett-szindróma diagnosztizálását javasolták, de rendellenességeket nem észleltek MeCP2. Új homozigóta mutációt azonosítottunk a MFSD8 gén (kb. 525 T> A, p. Cys175Ter). Tudomásunk szerint ez az első jelentés MFSD8 génmutáció orosz páciensben, késői infantilis NCL variánssal.
Következtetések
Eredményeink megnövelik a ceroid lipofuscinosis 7-es típusú mutációs spektrumát, és kimutatják az exome szekvenálás óriási diagnosztikai értékét gyermekkori NCL-eknél. Megerősítettük azt is, hogy az NCL-t gyanítani kell azoknál a betegeknél, akiknél Rett-szerű fenotípus van megjelenéskor és negatív MECP2 mutáció.
Háttér
A neuronális ceroid lipofuscinosisok (NCL-k), más néven Batten-kór, az autoszomális recesszív lizoszomális tárolási betegségek csoportja. Autoszomális domináns öröklődésről egy felnőttkori formában számoltak be [1]. Az NCL a leggyakoribb a gyermekkori neurodegeneratív rendellenességek között, prevalenciája világszerte legfeljebb 1: 14 000 [2]. Az NCL-k a kognitív és motoros készségek progresszív elvesztésével, görcsrohamokkal, myoclonusral, látásvesztéssel és általában a várható élettartam csökkenésével járnak. A megjelenés kora változó lehet. Szinte minden NCL-betegben autofluoreszcens lipopigment halmozódott fel az idegsejtek és más sejttípusok lizoszómáiban. Ez a tárolási folyamat az agy és a retina neuronjainak szelektív megsemmisülésével és elvesztésével jár. A tárolók ultraszerkezete az NCL különböző formái között változó [3].
Korábban az NCL osztályozás a kezdet korán és a klinikai megjelenésen alapult. A betegeket négy alapvető NCL típus egyikébe csoportosították: infantilis, késői infantilis, fiatalkorú és felnőtt [4].
A mai napig több mint 440 NCL-t okozó mutáció ismert 13 génben [5]. Az új osztályozás 7 diagnosztikai tengelyre tagolva: felelős gén, pontos genetikai hiba, klinikai jellemzők (életkor a megjelenéskor, a tünetek megjelenése, a betegség progressziója), biokémiai fenotípus, ultrastrukturális jellemzők, funkcionalitás és egyéb megjegyzések [6]. De nem mindig létezik közvetlen összefüggés a mutált gén és a fenotípus között [7].
A késői infantilis NCL-eken belül több, diszkréten eltérő klinikai jellemzőkkel rendelkező típust írnak le és különítenek el a késői infantilis NCL (vLINCL) variánsokra. A vLINCL-ek genetikailag heterogén formák, négy fő betegséget okozó génnel: CLN5, CLN6, CLN7 (MFSD8), CLN8. Homozigóta vagy összetett heterozigóta mutációk a MFSD8 korábban beszámoltak arról, hogy NCL7 betegségnek nevezett vLINCL-t okoznak (OMIM 610951). MFSD8 gén (OMIM 611124) a CLN7-et, egy feltételezett lizoszómális transzporter fehérjét kódolja [8].
Az NCL7 formát először törökországi gyermekeknél írták le: Topcu kollégáival 36 későn infantilis NCL-ben szenvedő török páciens klinikai és hisztopatológiai jellemzőit értékelte [9]. Ezt a formát az NCL különálló klinikai és genetikai változatának tekintették, de a későbbi vizsgálatok azt mutatták, hogy az NCL7 betegség nem korlátozódik a török populációra [8, 10, 11]. Most nyilvánvaló, hogy a török vLINCL genetikailag nagyon heterogén, három gén mutációjával: CLN6 [12], CLN8 [13] és MFSD8 [14]. Az infantilis és a késői infantilis NCL-ek különböző variánsaival rendelkező betegek klinikai fenotípusa meglehetősen egységes. Ugyanakkor Rett-szerű kezdetet írtak le az NCL7 betegségre vonatkozóan, amelyet a MFSD8 génmutációk és infantilis NCL1 betegség [9, 15, 16]. Hasonló autista jellemzőket és sztereotip mozgásokat figyeltek meg az NCL több formájában is [17, 18].
Ebben a tanulmányban egy 5 éves, kognitív és motoros romlással, látásvesztéssel, sztereotípiákkal, akciós mioklonussal és epilepsziával rendelkező lány klinikai és genetikai jellemzőit elemeztük.
Eset bemutatása
A beteg egy 5 éves orosz lány volt. Nem figyelemre méltó perinatális, újszülöttkori és családi kórtörténete volt (a szülők és a testvér klinikailag egészségesek).
Az ötödik terhességtől, a második szüléstől született, és császármetszéssel szülték. Születési súlya 3800 g, magassága 53 cm volt. Az Apgar-pontszám 8, illetve 8 volt az 1., illetve az 5. percnél. Az újszülött korában nem észleltek rendellenességeket. 2,5 éves korig a lány életkorának megfelelően fejlődött, a beszéd és a motor fejlődésének késedelme nélkül. 2,5 éves korában a kisujj traumája miatt a lány abbahagyta a beszélgetést. Fokozatosan helyreállt a beszéd, de a szókincs csökkent. 3 év elteltével bekövetkezett az első lázas roham. A későbbi szülők észrevették, hogy beszéde és kommunikációja jelentősen romlik. Társadalmi visszahúzódássá vált. Az agyi mágneses rezonancia képalkotása diffúz elváltozásokat tárt fel az alsó cerebelláris vermis fehérállományában és hypoplasiáját. 3, 5 éves korban sztereotip mozgások jelentek meg. 3, 5 éves kortól kezdve a beteget valproinsavval (epilepszia elleni gyógyszer) kezdték meg. De a motorromlás előrehaladt: 5 éves korára abbahagyta a járást.
A megfigyelt tünetek alapján a Rett-szindróma diagnosztizálását javasolták. A klinikai exóm-szekvenálás előtt a következő vizsgálatokat hajtották végre: a palmitoil-fehérje tioészteráz (PPT) szintjének mérése leukocitákban, tandem tömegspektroszkópia, MeCP2 és TPP1, a közös mitokondriális DNS mutációk elemzése. Minden vizsgálat nem mutatott rendellenességeket.
5 éves korában 8 hónapos korában felvették a Gyermekpszichoneurológiai Tudományos és Gyakorlati Központba motoros és mentális romlással, látássérüléssel és sztereotípiákkal.
Normális fizikai fejlődése volt: 20, 5 kg súlyú és 111 cm magas. A fej normális alakú, a fej kerülete 50, 5 cm (normális). A bőr normális és tiszta volt. A has puha, fájdalommentes volt. A széklet és a vizeletürítés normális volt. Az alapvető vér- és vizeletvizsgálatok normálisak voltak.
Nem érdeklődött a környezet iránt, nem volt játék. A térben és időben való tájékozódás hiányzott. A beszéd és a beszéd megértése zavart: csak beszédhangokat és szótagokat használt. Sztereotip mozdulatai voltak a kezén és az arcán. A lány kezén, lábán és arcizmain myoclonus van. A tapintható stimuláció fokozza a mioklonust. Nem jár, nem áll, nem mászik. Egy lány csak időszakos esésekkel tarthatja a fejét, borulhat fel, ülhet.
A szemészeti értékelés a látóidegek részleges atrófiáját, nistagmust, retinitis pigmentosát és vegyes asztigmatizmust mutatott ki.
Az EEG (elektroencefalográfia) jelentős késést mutatott ki a kortikális elektrogenezis kialakulásában, és rosszul strukturált epileptiform aktivitást mutatott az occipitalis-parietalis-posterior temporális régiókban.
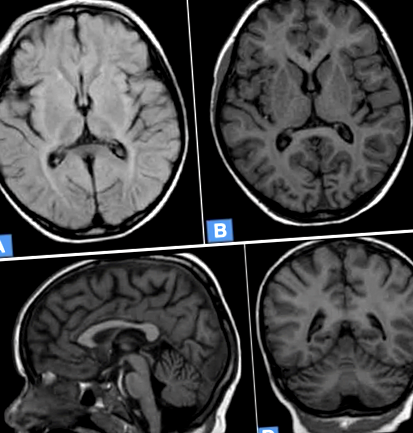
Az MRI (mágneses rezonancia képalkotás) agykérgi atrófiát, mindkét agyfélteke periventrikuláris leukopátiáját és a kisagy atrófiáját tárta fel (1. ábra).
5 éves kislány agyi MRI-je NCL7-vel. a. Diffúz kortikális atrófia, az MR jel intenzitásának növekedése periventrikuláris fehérállományban. Axiális T2 súlyozott FLAIR kép. b. Diffúz agykérgi és szubkortikális atrófia. Axiális T1 súlyozott kép. c. A kisagy atrófiája, az agy kérgi atrófiája. Sagittal T1 súlyozott kép. d. Az agy diffúz kortikális és szubkortikális atrófiája, a kisagy sorvadása. Frontális T1 súlyozott kép
Az EKG (elektrokardiográfia) súlyos sinus bradyarrhythmia-t mutatott. A pulzus 48–84 ütés/perc volt.
A kórházban görcsoldó gyógyszerekkel kezelték: topiramát (100 mg/nap) és levetiracetám (1200 mg/nap).
MFSD8 az exome szekvenálással azonosított variánst Sanger szekvenálással igazoltuk.
Megbeszélés és következtetések
Ebben a cikkben egy 5 éves kislány esetét írtuk le motoros és mentális romlással, progresszív látásvesztéssel, sztereotípiákkal, akciós mioklonussal és epilepsziával. A betegségnek Rett-szerű kezdete volt (pszichomotoros regresszió, sztereotip kézmozdulatok). Ezért a klinikai exómszekvenálás előtt a Rett-szindrómát kizárták a MeCP2. A gyakori mutációk és a biokémiai indexek elemzését számos betegség esetében elvégeztük: aminoacidopathiák, szerves aciduria, NCL1, NCL2, mitokondriális zsírsavbetta-oxidációs rendellenességek, MELAS (mitokondriális encephalopathia, tejsavas acidózis és stroke-szerű epizódok), MERRF-szindróma (myoclonic epilepsia) rongyos vörös rostokkal), NARP (neuropathia, ataxia és retinitis pigmentosa). Minden eredmény negatív volt.
Az exome szekvenálás homozigóta c.525 T> A variánsát mutatta ki a 6. exonban MFSD8 (NM_152778.2). Ez a változat egy idő előtti stop kodonhoz vezet (p.Cys175Ter). Ezt a homozigóta mutációt Sаnger-szekvenálás igazolta (2. ábra).
Elektroforegram a homogén, c. 525 T> A exon változásának Sanger-szekvenciájából. MFSD8, amely p.Cys175Ter változást jósol
Erről a mutációról 60 706 alany nem számolt be az ExAC-ban [34], illetve 2535 alanyban nem jelent meg az 1000 Genomes Browser [32]. Ezt a mutációt nem találtuk meg a 2000 házon belüli exomeinkban.
A felfedezett variáns kórokozónak jósolták. Ez a variáns 175 aa fehérjét érinti a transzmembrán ɑ hélixben. Ez a nonszensz variáns csonka fehérjét eredményezhet, amely nem működik, vagy nonszensz által közvetített bomlás révén az mRNS lebomlásához vezet [40].
Ezt a mutációt korábban nem írták le, de ennek a génnek a homozigóta vagy összetett heterozigóta mutációi társulnak a ceroid lipofuscinosishoz. A mai napig 38 mutáció van MFSD8 korábban leírták, a legtöbb homozigóta missense mutáció [5, 11]. Ez a mutáció túlnyomórészt NCL7 betegséghez vezet - a vLINCL forma altípusához. Szinte minden érintett egyén fenotípusai nagyon hasonlóak a mutáció típusától függetlenül [41].
Az NCL7 betegség tünetei általában 2 és 11 év között kezdődnek (átlagosan 5 év). A kezdeti jellemzők általában rohamok és a korábban megszerzett készségek elvesztése. A betegség előrehaladtával mentális regresszió, myoclonus, beszédzavar, látásvesztés alakult ki [15].
MFSD8 gén, amely a 4q28.1-q28.2 kromoszómán található, a CLN7-et kódolja, egy feltételezett lizoszomális transzportert, 12 transzmembrán domén javasolt topológiájával, amelyről kiderült, hogy a lizoszomális membránon lokalizálódik, és a fő facilitátor szupercsaládhoz (MFS) tartozik. Ezek a fehérjék egypolipeptid hordozók, amelyek képesek kisméretű oldott anyagokat szállítani kemioszmotikus iongradiensek alkalmazásával [42]. Az MFSD8 lizoszomális membránon keresztül szállító specifikus molekulákat nem sikerült azonosítani. Bár ez a fehérje mindenütt expresszálódik, magas transzkriptumkoncentrációkat azonosítottak számos agyi helyen, például a kisagykéregben és a hippokampuszban [43].
A neurodegeneratív rendellenességek diagnosztizálásának előrehaladása ellenére az NCL-k továbbra is kihívást jelentenek a gyermekneurológusok számára, mivel a kisgyermekek vagy kisgyermekek klinikai tünetei finomak és gyakran átfedik más veleszületett neurodegeneratív betegségekkel, például mitokondriális rendellenességekkel, Rett-szindrómával vagy a korai kialakulású parkinsonismussal. Craiu kollégáival arra a következtetésre jutott, hogy az NCL-t gyanítani kell azoknál a betegeknél, akiknél Rett-szerű fenotípus van megjelenéskor és negatív MECP2 mutáció [15]. Betegünk betegségében Rett-szerű tünetek jelentkeztek, amelyek diagnosztikai késleltetést okoztak. Mind a Rett-szindróma, mind az NCL-ek normális fejlődést mutatnak 9–24 hónapos korig. Craiu és mtsai. a cikk NCL7 betegségben szenved, Rett-szerű kezdete 18 hónaposan. Esetünk késői megnyilvánulása 2,5 év, ami megnehezítette a diagnosztizálást. Az NCL-ek genetikai megértésének növekedése jobb diagnosztikai megközelítéseket eredményezett. Vizsgálatunkból kiderült, hogy a motoros és mentális regresszióban szenvedő betegek korai szemészeti vizsgálata hasznos lehet a diagnózis felállításában.
Bár ennek az állapotnak nincs kezelési módja, a helyes és korai diagnózis fontos a gyengénlátók megfelelő kezeléséhez, az oktatás tervezéséhez és a genetikai tanácsadáshoz.
Ez a jelentés az NCL7 betegség első esetét írja le Oroszországban. Megállapításaink kibővítették a MFSD8 és bizonyította az exome szekvenálás értékét gyermekkori NCL-eknél.
Rövidítések
Amerikai Orvosi Genetikai és Genomikai Főiskola
- Az amilorid a rezisztens ödémát és a magas vérnyomást oldja nephrotikus szindrómás betegeknél; egy ügy
- Az ülő orosz csavar 10 elképesztő előnye
- Útmutató a bariatrikus sebészet és az ObGyn beteg MDedge ObGyn klinikusainak
- A legjobb edzés a testtípus homokóra vagy kanyargós testforma magazin számára
- Egy dagestani nyugdíjas, aki egy menet alatt csaknem 10 kg-ot fogyott, elmondta rekordját - RT oroszul