Nátrium-tioszulfát
Az ST-t és a szulfitokat a hámozott gyümölcsök és zöldségek gombás romlásának és megbarnulásának megakadályozására használják, és felelősek az allergiás reakciók kiváltásáért (Vally et al., 2009).
Kapcsolódó kifejezések:
- Nitrit
- Nátrium-nitrit
- Tiocianát
- Tioszulfát
- Hidroxokobalamin
- Toxicitás
- Titrálás
- Agar
- Bendő
- Protozoa
Letöltés PDF formátumban
Erről az oldalról
Hidrogén-szulfid a Redox Biology-ban, A. rész
Ruma Banerjee,. Pramod K. Yadav, in Methods in Enzymology, 2015
3.3 Rhodanese-vizsgálatok
3.3.1. A tiocianát Rodanese-képződésének vizsgálata
1 M nátrium-tioszulfát
1 M kálium-cianid
15% (w/v) formaldehid oldat
Vas-nitrát-nonahidrát-oldat (6,6 g Fe (NO3) 3 × 9H2O 3,4 ml salétromsavban oldva. A végső térfogatot 50 ml-re állítjuk).
300 mM HEPES puffer, pH 7,4, amely 150 mM NaCl-ot tartalmaz.
Módszer: Polisztirol küvettába adjunk 12,5 μl nátrium-tioszulfátot, 12,5 μl kálium-cianidot és 225 μl HEPES puffert 25 ° C-on. A reakciót 0,5 μg rodán hozzáadásával indítjuk. 5 perc elteltével a reakciót 250 μl 15 tömeg/térfogat% formaldehid hozzáadásával állítjuk le, és a reakcióelegyet 5 percig 10 000 x g-vel centrifugáljuk a fehérje eltávolítása céljából. 0,5 ml vas-nitrát hozzáadása a felülúszóhoz vörös szín kialakulását eredményezi a vas-tiocianát képződés miatt, amelyet 460 nm-en figyelnek. Párhuzamosan futtatunk egy kontrollreakciót, amelyből hiányzik a rodán. A képződött tiocianát mennyiségét 0,1-5 μmol tiocianáttal létrehozott standard görbe segítségével határozzuk meg. Az enzimaktivitás egy egysége 1 μmol tiocianát képződését katalizálja min - 1 25 ° C-on. A fajlagos aktivitás mértékegysége mg fehérje - 1 .
3.3.2 Rhodanese tioszulfát-termelésének vizsgálata
1 M nátrium-tioszulfát
100 mM nátrium-szulfit
50 mM GSSH (az elkészítéshez lásd a 3.2.1. Szakaszt)
100 mM monobromobimán DMSO-ban oldva
100% ecetsav
0,2 mM nátrium-citrát, pH 2,0
100 mM HEPES puffer, pH 7,4, amely 150 mM NaCl-ot tartalmaz
Módszer: A vizsgálati keveréket 2 μl nátrium-szulfit, 8 μl GSSH 200 μl HEPES-pufferben és 1 μg rodán keverésével készítjük. A reakciót 1 μg rodán hozzáadásával indítjuk és 5 percig inkubáljuk 25 ° C-on, majd a mintákat 2 μl monobromobimánnal derivatizáljuk. Az inkubálást 10 percig folytatjuk, majd megsavanyítjuk 100 μl nátrium-citráttal. Ezzel párhuzamosan egy kontroll reakciót készítettünk, amelyből hiányzott a rodanész. A derivatizált mintákat 10 000 x g-vel 10 percig 4 ° C-on centrifugáljuk, és 50 μl felülúszót injektálunk egy C8 reverz fázisú HPLC-oszlopra (4,6 × 150 mm, 3 μm-es csomagolás, Phenomenex), amelyet 80% -os oldószerrel előzetesen kiegyensúlyozunk. A (10% metanol és 0,25% ecetsav) és 20% B oldószer (90% metanol és 0,25% ecetsav). A mintát a következő gradiens alkalmazásával eluáljuk: B oldószer: 20% 0-10 percig, 20-40% 10-25 percig, 40-90% 25-30 percig, 90-100% 30-32 percig, 100% 32-35 percig, 100-20% 35-37 percig és 20% 37-40 percig. Az áramlási sebesség 0,75 ml min - 1. A tioszulfát bimán-adduktuma a
22 percig ilyen körülmények között, 340 nm-en gerjesztéssel és 450 nm-en történő emisszióval detektáljuk. A tioszulfát koncentrációját ismert koncentrációjú tioszulfát-standardok alkalmazásával határozzuk meg. Az enzimaktivitás egy egysége 1 μmol tioszulfát képződését katalizálja min - 1 25 ° C-on. A fajlagos aktivitást mg/1 fehérje egységben fejezzük ki.
3.3.3. A H2S termelésének vizsgálata rodánnal
1 M nátrium-tioszulfát
200 mM glutation
200 mM cisztein
200 mM homocisztein
100 mM ólom-acetát
100 mM HEPES puffer, pH 7,4, amely 150 mM NaCl-ot tartalmaz
Módszer: A reakcióelegyet polisztirol küvettába készítjük 1,5 μl tioszulfát, 50 μl glutation (vagy 50 μl cisztein vagy 100 μl homocisztein), 2 μl ólom-acetát és 350 μl HEPES puffer hozzáadásával 500 μl végtérfogatban. A küvettát 4 percig 37 ° C-on tartott spektrofotométerbe helyeztük. A reakció 1–10 μg rodán hozzáadásával indul. Figyeljük az ólom-szulfid képződéséből adódó abszorbancia növekedését 390 nm-en. A fajlagos aktivitást 5500 M - 1 cm - 1 moláris extinkciós együtthatóval számítják ki ólom-szulfidra (Singh et al., 2009).
A vér-agy gát farmakológiája: CNS-rendellenességek célzása
Nancy D. Doolittle,. Edward A. Neuwelt, a farmakológia fejlődésében, 2014
4 Kemovédelmi vizsgálatok
A platina alapú kemoterápia progresszív és irreverzibilis ototoxicitással társul, és csontvelői toxicitást, vesetoxicitást és hepatotoxicitást is okozhat. A platina által kiváltott toxicitásokat legalább részben a szabad gyökök károsodása közvetíti. A kéntartalmú tiol kemoprotektív szerek, amelyek utánozzák az endogén antioxidáns glutation aktivitását, megvédhetnek a szabad gyökök károsodásaitól és a kemoterápiás toxicitástól. Preklinikai és klinikai vizsgálataink a kemoprotektálást értékelték STS és N-acetilcisztein (NAC) alkalmazásával.
4.1 Preklinikai kemoprotektív vizsgálatok tiolokkal
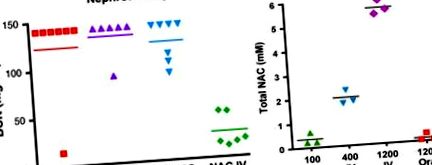
11. ábra A dózis és az alkalmazás módjának hatása az N-acetil-cisztein (NAC) kemovédelemre. (A) Nehézvédelem. A patkányok nephrotoxikus dózisban kapták a ciszplatint, majd 4 óra alatt orális vagy iv. A NAC szignifikánsan csökkentette a ciszplatin által kiváltott vesetoxicitást, ha intravénásán adták, de nem orálisan. (B) NAC farmakológia. A szérum NAC-koncentrációkat HPLC-vel mértük 15 perccel iv. Vagy orális beadás után. A NAC kemoprotektív dózisai (400–1000 mg/kg) 2 mM vagy annál magasabb csúcskoncentrációt eredményeztek csak IV-ben adva, és nem voltak hatékonyak intraperitoneális vagy orális alkalmazás esetén.
A kemoprotekció klinikai alkalmazását korlátozta a rák kemoterápiás toxicitással szembeni védelme. In vitro vizsgálataink kimutatták, hogy bár mind az STS, mind a NAC védelmet nyújt a tumorsejtekkel szemben, ha kemoterápiával egyidejűleg adják be őket, a tumorsejtek védelme elveszett, ha a tiolok 2–4 órával késnek (Muldoon et al., 2001; Wu, Muldoon és Neuwelt, 2005). Az STS nem volt tumorvédő egy neuroblastoma egérmodellben, ha a ciszplatin után 6 óráig késett (Harned és mtsai., 2008). A tüdőrák agyi metasztázis patkánymodelljében 8 órás késleltetett STS, 1 órás NAC előkezelés vagy a NAC előkezelés és az STS utókezelés kombinációja nem befolyásolta a karboplatin kemoterápia tumorellenes hatékonyságát (Neuwelt et al., 2004). Továbbá értékeltük a NAC időzítésének hatását a ciszplatin hatékonyságára gyermekdaganatok patkánymodelljeiben (Muldoon, Wu, Pagel és Neuwelt, publikálásra benyújtva). Megállapítottuk, hogy a NAC-val történő előkezelés szignifikánsan csökkentette a ciszplatin hatékonyságát mind a szisztémás szilárd tumor modellben (neuroblastoma), mind az intracerebrális tumor modellben (medulloblastoma). Ezzel szemben a NAC késése a ciszplatin után 4 óráig nem csökkentette a kemoterápia hatékonyságát egyik tumor modellben sem.
4.2 Klinikai kemoprotektív vizsgálatok tiolokkal
A rosszindulatú agydaganatok kezelésére alkalmazott intenzív kemoterápiás stratégiák szükségessé teszik a központi idegrendszer és a szisztémás toxicitások minimalizálását. A karboplatin hatékonyságot mutatott rosszindulatú agydaganatokban. A karboplatin azonban mieloszuppressziót okoz, beleértve súlyos thrombocytopeniát is, gyakran trombocita transzfúziót és a későbbi karboplatin kezelések dózisának csökkentését igényli. BBBD-vel együtt alkalmazva a karboplatin (IA) az alanyok nagy részében irreverzibilis halláskárosodást okoz (Doolittle, Muldoon és mtsai., 2001; Neuwelt, Brummett és mtsai, 1998).
12. ábra A nátrium-tioszulfát (STS) hallásvédelmet mutat malignus agydaganatos felnőtteknél. A hallásküszöb-eltolódás összehasonlítása a karboplatin-kezelési számmal 4000 Hz-en történeti összehasonlításban agydaganatos betegeknél, akiket STS nélkül karboplatinnal (intraarterialis [IA]) kezeltek vér-agy gát rendellenességgel (BBBD), és késleltetett STS-vel kezelt agydaganatos betegeknél. 2 óra (STS2) vagy 4 óra (STS4) BBBD-vel végzett karboplatin (IA) után. Jelentős különbség volt a hallásvédelemben az STS kezelési csoportok és a korábbi összehasonlító csoport között (P = 0,0075).
Újranyomtatva Doolittle, Muldoon és mtsai. (2001) .
A NAC I. fázisú klinikai vizsgálata endovaszkuláris eljárásokon átesett felnőtt betegeknél majdnem teljes. Tizenhat beteget randomizáltak IV vagy IA NAC kezelésre egy szokásos dózisnövelési vizsgálatban. Amint a vizsgálat befejezéséhez közeledik, úgy tűnik, hogy a NAC MTD 300–450 mg/kg tartományban van. I. fázisú NAC dózisemelés-vizsgálat folyik különböző rákdiagnosztikájú gyermekeknél, akiket ciszplatin-alapú kemoterápiával kezelnek.
ANTIOXIDÁNOK | Szintetikus antioxidánsok
Nátrium-tioszulfát
A kén hozzáadása a nátrium-szulfithoz nátrium-tioszulfátot eredményez, amely só S – S kötést tartalmaz. Antioxidáns tulajdonságai a redukált kénatom jelenlétének köszönhetők, de erős komplexeket is képez vas-, réz- és egyéb fémionokkal. Hozzáadható alkoholtartalmú italokhoz (0,00005%) és asztali sóhoz (
Vér – agy gátat zavaró kemoterápia
Nancy D. Doolittle,. Edward A. Neuwelt, az agytumor kemoterápia kézikönyve, 2006
A THIOL KÉMIVÉDELEM KLINIKAI VIZSGÁLATA
A klinikai vizsgálatok hallásvédelmet mutattak ki, amikor nagy dózisú STS-t (16–20 g/m 2) adtak be kétkamrás modell részeként malignus agydaganatokban szenvedő betegeknél [24, 25]. Vagyis a karboplatint intraarteriálisan adták be közvetlenül a BBBD után. A nagy dózisú STS-t késleltetett módon, intravénásán, 4 (vagy 4 és 8) órával a karboplatin után adták be, ezáltal térbeli és időbeli elkülönítést biztosítva a kemoterápia és a kemoprotektor között. A tanulmány egyértelmű védőhatást mutatott a karboplatin által kiváltott hallásvesztés ellen [25].
Áttekintettük a rosszindulatú agydaganatokban szenvedő betegek hematológiai adatait, akiket karboplatinnal (intraarteriásan), ciklofoszfamiddal (intravénásan) és etopozid vagy etopozid-foszfáttal (intraarteriálisan vagy intravénásan) kezeltek BBBD-vel (n = 29) vagy anélkül (n = 24). késleltetett nagy dózisú STS a hallásvédelem érdekében (lásd a 18.2. táblázatot) [42]. Az STS-t 4 (vagy 4 és 8) órával a karboplatin után adtuk be. A 3. vagy 4. fokozatú thrombocyta-toxicitás (NCI Common Toxicity Criteria) aránya STS nélkül 47,8%, STS esetén 17,2% volt; STS-kezelés nélküli betegeknél a 3. vagy 4. fokozatú thrombocyta-toxicitás szignifikáns összefüggést mutatott (p = 0,0018). Az előzetes kemoterápiát kontrolláló karboplatin dóziscsökkentési aránya statisztikailag szignifikáns volt a két csoport között (p = 0,0046). Ezek az eredmények arra utalnak, hogy az STS védelmet nyújthat a súlyos thrombocytopenia ellen, csökkentve a thrombocyta transzfúziók számát és csökkentve a karboplatin dózisát.
18.2. TÁBLÁZAT Százalékos betegek és százalékos karboplatin-tanfolyamok 20 × 10/mm 3 alatti trombocita nadírral, a vérlemezke-transzfúziót igénylő betegek és karboplatin-tanfolyamok százaléka, valamint a karboplatin-dózis csökkentését igénylő betegek százaléka
| Karboplatin/nincs STS | |||
| n = 24 beteg | A betegek 25% -a | A betegek 33% -a | A betegek 33% -a |
| 125 tanfolyam | 7% tanfolyam | 9% tanfolyam | |
| Karboplatin/STS | |||
| n = 29 beteg | A betegek 4% -a | A betegek 7% -a | 0% beteg |
| 129 tanfolyam | 1% tanfolyam | 2% tanfolyam |
Véletlenszerű klinikai vizsgálat folyik a késleltetett nagy dózisú STS hatásának a trombocitaszámra történő pontosabb meghatározására malignus agydaganatokban. A prospektív klinikai vizsgálat magában foglalja a karboplatint (intraarteriális), a ciklofoszfamidot (intravénásan) és az etopozid-foszfátot (intravénásan) BBBD nélkül, magas fokú gliómában szenvedő betegeknél, késleltetett nagy dózisú STS-ben (intravénásan) vagy nem STS-ben randomizált alanyokkal. . Az elsődleges végpontok a vérlemezkék legalacsonyabb értéke 3/mm 3, és a vérlemezke transzfúziót igénylő alanyok százaléka. A tumor válaszát és a válasz időtartamát figyelemmel kísérjük, hogy határozottabban meghatározzuk az STS klinikai eredményekre gyakorolt hatását.
A ciszplatin széles körben alkalmazott és hatékony kemoterápiás szer, azonban magas a társult toxicitások előfordulása, beleértve a hallás toxicitását is. Vita tárgyát képezi egy leendő 3. fázisú Gyermekek Onkológiai Csoportjának vizsgálata, amelynek során a késleltetett nagy dózisú STS-t számos olyan gyermekkori szövettanban értékelik, amelyeket rutinszerűen ciszplatinnal (intravénásan) kezelnek. Ez a vizsgálat azt fogja értékelni, hogy a késői STS-kel ellátott hallásvédelem elérhető-e a gyermekpopulációban a daganatellenes hatékonyság csökkentése nélkül.
A toxicitás felmérése és a karboplatin-alapú kemoterápiával együtt alkalmazott NAC maximális tolerálható dózisának meghatározása céljából malignus agydaganatokban szenvedő betegeknél az 1. klinikai fázisú NAC dózisemelés-vizsgálat folyik. A NAC-ot intravénásan adják be 60 perccel a BBBD és a karboplatin (intraartériás) alapú kemoterápia előtt. Egy külön felülvizsgálat alatt álló vizsgálatban a NAC-t a csökkenő aortában adjuk be 30 perccel a BBBD előtt.
A hemolimfa és immunrendszer betegségei
Kezelés
A szokásos elsődleges kezelés a nátrium-nitrit és nátrium-tioszulfát (5 g nátrium-nitrit és 15 g nátrium-tioszulfát 200 ml vízben marháknak; 1 g nátrium-nitrit és 3 g nátrium-tioszulfát 50 ml vízben juhoknak) IV-es injekciója, és a terepi tapasztalat nagyon jó volt. A kérődzőket sikeresen kezelték 30–40% -os nátrium-tioszulfát oldattal, 25-50 g/100 kg testtömeg és nátrium-nitrit nélkül. 12 A lovaknak 10-20 mg/kg IV nátrium-nitritet adhatunk 20% -os oldatban, majd 30-40 mg/kg testtömegű nátrium-tioszulfát IV-t 20% -os oldatban. 13.
A szarvasmarhákban elért eredmények a következő dózisok alkalmazásával javíthatók:
Nátrium-tioszulfát sokkal nagyobb adagban (660 mg/testtömeg-kg 30% -os oldatban) 13
Nátrium-tioszulfát nehéz adag nátrium-nitritrel (22 mg/testtömeg-kg) kombinálva
Nátrium-tioszulfát nagy adag p-aminopropriofenonnal (1–1,5 mg/ttkg)
Nátrium-tioszulfát nehéz adag plusz kobalt-klorid (10,6 mg/ttkg)
Minden esetben és olyan állatoknál, akik ki vannak téve a tüneteknek, 30 g nátrium-tioszulfát adagot adnak szájon át a szarvasmarháknak, és óránként megismételik őket.
Vizsgálati kezelések
A hidroxokobalamint, a B12-vitamin természetes formáját számos országban sikeresen használják antidotumként emberi lények, kutyák, egerek, tengerimalacok, nyulak és páviánok ellen. A sertésekben végzett legújabb munka kimutatta, hogy a hidroxokobalamin (150 mg/testtömeg-kg) hatékonyabban, mint a nátrium-tioszulfát (413 mg/testtömeg-kilogramm), vagy a hidroxokobalamin és a nátrium-tioszulfát kombinációja a kísérletileg kiváltott cianid-mérgezés kezelésében. 15
A szulfanegen-nátrium (2,5 gramm iv. Bolus; óránként ismételve), a 3-merkaptopiruvát prodrugja egy kísérleti sertésmodellben hatékonyan fordította vissza a központi idegrendszer (CNS) jeleit, és a jövőben újabb antidotumot jelenthet. 16.
A kezelést, függetlenül attól, hogy melyik terméket alkalmazzák, meg kell ismételni a HCN további felszabadulása miatt. A biztonságos methemoglobinemia felső határa meghaladja az anémiás anoxiát, és az ajánlottnál nagyobb nitrit dózis súlyosbíthatja a szöveti anoxiát. A kobalt felvétele a cianid elleni jelentős antagonista hatásán alapul, amelyet tioszulfáttal vagy nitritrel kombinálva fokozhat.
A nem specifikus támogató kezelések, köztük a légzésstimulánsok és a mesterséges lélegeztetés, valószínűleg nem befolyásolják a betegség lefolyását.
Kezelés és profilaxis
Kérődzők (További lehetőségekért lásd a szöveget)
Mind: nátrium-tioszulfát 660 mg/ttkg IV 30% -os oldatban (R1)
Tehenek: 5 g nátrium-nitrit, 15 g nátrium-tioszulfát IV 200 ml vízben (R2)
Juh: 1 g nátrium-nitrit, 3 g nátrium-tioszulfát 50 ml vízben (R2)
Lovak
Nátrium-nitrit (10-20 mg/ttkg IV 20% -os oldatban), majd nátrium-tioszulfát (30-40 mg/ttkg IV 20% -os oldatban) (R1)
- Rubus Chamaemorus - áttekintés a ScienceDirect témákról
- Tisztító és csapdázó technika - áttekintés a ScienceDirect témákról
- Pyelonephritis - áttekintés a ScienceDirect témákról
- Táplálékkiegészítő - áttekintés a ScienceDirect témákról
- Nátrium-tioszulfát - áttekintés a ScienceDirect témákról