Miért volt édesanyádnak igaza: Hogyan csökkenti a káliumbevitel a vérnyomást?
Absztrakt
A nyugati étrendben gyakori alacsony káliumbevitel növeli a vérnyomást és fokozza a sóérzékenységet. A „nyugatiasított” országokban élő emberek többsége szintén felesleges sót fogyaszt. Egerek felhasználásával végzett vizsgálatok során azt tapasztaltuk, hogy a magas sótartalmú és alacsony káliumtartalmú étrend aktiválja a tiazid-érzékeny Na-Cl kotranszportert a vesében. Ez a hatás nátrium-visszatartáshoz és megnövekedett vérnyomáshoz vezetett, és a plazma káliumtól függ. Feltételeztük, hogy ezt a hatást a membránfeszültség változásai okozta intracelluláris klorid változásai közvetítik. A tenyésztett sejtekben kifejlesztettünk egy modellt, amely lehetővé teszi számunkra, hogy megerősítsük ezt a hipotézist. Ezután a vizelet exoszómáinak segítségével megerősítettük, hogy normális emberek étrendi változásai ugyanúgy befolyásolják a tiazid-érzékeny Na-Cl kotranszportert. Ezek az adatok azt mutatják, hogy az étrendi káliumhiány nagyban növeli a vérnyomást azáltal, hogy a disztális nefron mentén stimulálja a só visszaszívódását. Azt javasolják, hogy a globális erőfeszítéseknek a káliumbevitel növelésére kell összpontosítaniuk, ami enyhíti a magas sótartalmú étrend hatásait.
BEVEZETÉS
A világon az emberek többsége napjainkban viszonylag magas só (NaCl) és alacsony kálium (K +) étrendet fogyaszt (1). Az ilyen étrendet összefüggésbe hozzák magas vérnyomással, szív- és érrendszeri betegségekkel és minden okból bekövetkező halálozással. Összpontosítottunk a disztális tekervényes tubulusra (DCT) és a tiazid-érzékeny NaCl kotranszporterre, mivel a nephron ezen szegmense nemrégiben kimutatták, hogy modulálja a kálium kiválasztását. A DCT a legtöbb emlősfajban egy heterogén szegmens, amely egy proximális részt, a DCT1-et tartalmazza, amely elsősorban NaCl-t felszívja, és egy disztális részt, a DCT2-t, ahol az elektroneutrális NaCl transzport együtt jár az elektrogén Na + és K + transzportutakkal (2–5 ).
A tiazid-érzékeny NaCl kotranszporter (NCC, SLC12A3 génszimbólum) a domináns apikális Na + belépési út a DCT1 sejtekben, olyan sejtekben, amelyekben az elektrogén transzport nem megy végbe. Mivel a DCT sejtek ellenőrzik a NaCl bejutását az összekötő tubulusba is, ahol az epiteliális nátriumcsatorna (ENaC) közvetíti az elektrogén Na + visszaszívódást, és ahol a K + szekretálódik (6), úgy tűnik, hogy jelentős, bár közvetett szerepet játszanak a K + váladék. A DCT jelentősége a K + szekrécióban akkor vált nyilvánvalóvá, amikor az FHHt molekuláris oldata olyan molekuláris kapcsoló felfedezéséhez vezetett, amely „lizin nélküli” (WNK) kinázokat, Ste20p-vel kapcsolatos prolin alaninban gazdag kinázt (SPAK) és oxidatív anyagokat tartalmaz. stressz válasz 1 kináz (OxSR1). Úgy tűnik, hogy az FHHt-okozta betegségmutációk ezt a kapcsolót „be” helyzetbe rögzítik, ami az NCC visszafoghatatlan aktivitását eredményezi, ami hiperkalémiához és magas vérnyomáshoz vezet. Bár ez a patogenezis világos, a fiziológiai kapcsoló aktivátor jellege megfoghatatlan maradt.
Az NCC élettanilag aktiválódik, ha az étrendi NaCl bevitel csökken. Az NCC reagál az étrendi K + bevitel változásaira is. A magas KCl bevitel elnyomja (7–10), az alacsony KCl bevitel pedig növeli az NCC aktivitását (9,11,12). Ezek a hatások hozzájárulnak a szisztémás K + homeosztázishoz azáltal, hogy megváltoztatják a K + szekréciós szegmensekbe történő Na + leadását. Ezért arra törekedtünk, hogy meghatározzuk a DCT funkciót és az NCC aktivitását moduláló tényezőket.
ANYAGOK ÉS METÓDUSOK
Állatok
Az összes állatkísérletet az Oregoni Egészségügyi és Tudományegyetem Állattenyésztési és Felhasználási Bizottsága hagyta jóvá (IS918 protokoll). Az összes egér 12–24 hetes, 25–30 g volt, és C57Bl/6 háttérrel rendelkezett, kivéve az NCC -/- egereket, amelyek BALB/c háttérrel voltak.
Vérnyomásmérés
A nem invazív szisztolés vérnyomást farokköpenyekkel mértük térfogatnyomás-felvétel alkalmazásával (CODA-16; Kent Scientific, Torrington, CT, USA). Az egereket a felvétel előtt 5 egymást követő napon át hozzászokták a géphez. Az étrendi manipulációs vizsgálatok során az egereket az alap diétán tartották (magas NaCl [6%]/normál K + [1%]) (Harlan Laboratories, Indianapolis, IN, USA, K + -hiányos étrend [TD.88239] kiegészítve NaCl és KCl oldószerrel) 1 hétig, mielőtt a méréseket elvégeztük. Miután a kiindulási étrenden 4 napig regisztrálták a vérnyomást, az étrendeket magas NaCl/alacsony K + (0%) értékre változtatták. Az állatokat legalább 4 napig hagyjuk alkalmazkodni az új étrendhez, és ezen időszak után adatokat rögzítünk.
Vérelemzés
A teljes vért szívpunkcióval, altatásban gyűjtöttük össze. Az elektrolitokat az iSTAT segítségével mértük (Abbott Point of Care, Inc., Princeton, NJ, USA).
Immunblot
Az egereket 7-10 napig tartottuk a jelzett étrenden, vagy 5-7 napig amiloriddal (50 mg/l ivóvízzel) kezeltük, majd a veséket összegyűjtöttük és folyékony nitrogénben lefagyasztottuk. A veséket ezután jégen, proteáz és foszfatáz inhibitorokat tartalmazó hűtött pufferben homogenizáltuk. A fehérjét (20–80 μg) 4–12% (tömeg/térfogat) Bis-Tris gélen (Invitrogen, Grand Island, NY, USA) választottuk el.
Sejtkultúra
Flp-In NCC sejteket állítottunk elő, ahogy arról korábban beszámoltunk (14). A HEK293T sejteket (American Type Culture Collection) Dulbecco módosított Eagle táptalajában (Invitrogen) tenyésztettük 10% fetalis szarvasmarha szérummal (Invitrogen) 5% CO2-ban és 95% levegőben 37 ° C-on. A sejteket transzfekció céljából 50-70% -os összefolyásig növesztettük, és a megfelelő cDNS-eket egyidejűleg felvittük a sejtekre TurboFect transzfekciós reagenssel (Fermentas, Grand Junction, NY, USA). A K + megfordulási potenciál méréséhez egy Axon 200A patch-clamp erősítőt használtak, amint arról beszámoltak (15).
Humán tanulmányok
Az összes humán tanulmányt az Oregoni Egészségügyi és Tudományegyetem belső felülvizsgálati testülete jóváhagyta (IRB9934 protokoll). Az egészséges önkénteseket két különböző étrend, egy sós/alacsony K + étrend és egy magas só/K + tartalmú étrend fogyasztására kérték fel, mindegyiket 4 napos időtartamra. Az önkénteseket randomizálták a két diéta elfogyasztásának sorrendjébe. Minden étrend 5. napjának reggelén a vizeletet összegyűjtöttük és ultrakentrifugában centrifugáltuk egy korábban közzétett protokoll szerint (16).
EREDMÉNYEK
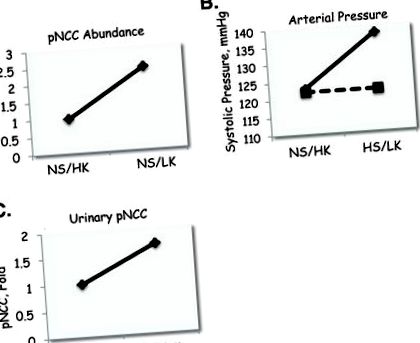
Egerekben azt tapasztaltuk, hogy az NCC és a foszforilezett NCC (pNCC, mint aktivációs index) nagyobb mennyiségben volt jelen magas sótartalmú/alacsony K + (HS/LK) étrendet fogyasztó egerek veséiben, mint magas sótartalmú/normál- K + (HS/NK) diéta (1. ábra A). Ezután kimutattuk, hogy a telemetrikusan mért átlagos artériás nyomás nőtt, amikor az egereket HS/NK-ról HS/LK-étrendre váltották (1. B ábra). Az artériás nyomás növekedése az LK diétán elsősorban az aktív időszakban volt, összhangban a korábbi jelentésekkel (11). Annak megállapításához, hogy az NCC aktiválása az LK diéta során hozzájárult-e a vérnyomás növekedéséhez, összehasonlítottuk az étrend hatását Slc12a3 -/- egerekben, amelyekben az NCC-t genetikailag törölték, és az alomtársakat. Ne feledje, hogy az Slc12a3 -/- egereknek normál vérnyomása van a kiinduláskor, amint arról korábban beszámoltunk (17). Az Slc12a3 -/- egerekben a vérnyomás nem nőtt az LK diéta alatt, míg az alomtársaknál (1. B ábra). A genotípus hatása az LK étrendre adott válaszra jelentős volt.
Az étrendi káliumbevitel hatása az NCC bőségére. (A) A magas sótartalmú/magas káliumtartalmú (HS/HK) és a magas sótartalmú/alacsony káliumtartalmú (HS/LK) étrend hatása a foszforilezett NCC (pNCC) mennyiségére, tetszőleges egységekben mérve. (B) Ugyanazon étrendek hatása az artériás nyomásra vad típusú egerekben (folytonos vonal) és NCC -/- egerekben (szaggatott vonal). (C) Hasonló étrendek hatása a pNCC-re humán önkéntesek urinjában.
Annak megállapítására, hogy az emberek hasonló reakciót mutatnak-e az étrendi K + bevitelre, elemeztük a pNCC-t vizelet exoszómákban (18, 19) olyan önkéntesektől, akik 4 napig HS/LK étrendet, majd 4 napig HS/NK étrendet fogyasztottak. A pNCC bősége szignifikánsan nagyobb volt a HS/LK diéta után, mint a HS/NK diéta után (1. ábra C). A diéták hasonló Na + és kalóriatartalommal bírtak, míg az étrendi K + különbözött.
A plazma káliumszintje szignifikánsan alacsonyabb volt az LK-t fogyasztó egerekben, összehasonlítva az NK-diétával (2,37 ± 0,13 vs. 3,38 ± 0,04). Néhányan mégis azt javasolták, hogy a K + -ot orálisan kell bevenni az NCC megváltoztatásához (8). A plazma [K +] szerepének teszteléséhez a K + bevitel megváltoztatása nélkül a plazmát [K +] farmakológiailag manipuláltuk a K + -ot kímélő diuretikus amiloriddal. Az amilorid közvetlenül gátolja az ENaC-t, ami K + retencióhoz vezet, de közvetlenül nem befolyásolja az NCC-t (20). Az egerek amiloriddal történő kezelése jelentős hiperkalémiát és (2. ábra A), valamint - amint azt egy magasabb hematokrit sugallja (2. ábra B) - extracelluláris folyadék (ECF) mennyiségének kimerülését okozta. Annak ellenére, hogy a mennyiség kimerült, amely várhatóan stimulálja az NCC-t, az amilorid csökkentette az NCC-t és a pNCC-t is, ami arra utal, hogy a K + jel felülírja az ECF jelet (2. ábra C). Mivel az amiloridnak lehetnek olyan hatásai, amelyek nem kapcsolódnak a plazma [K +] változásához, az egereket LK diétával és amiloriddal kezeltük, hogy a [K +] normális tartományban maradjon. Ez megakadályozta a hiperkalémiát (2. A ábra), a hematokrit változását (2. B ábra), valamint az NCC és a pNCC változását (2. ábra C). Ezek az eredmények együtt azt sugallják, hogy az étrendi K + bevitel az NCC-t a plazmára vagy a teljes test K-ra gyakorolt hatása révén befolyásolja + .
A plazma kálium hatása az NCC bőségére. (A) Plazma káliumkoncentráció vivőanyaggal (VEH), amiloriddal (AML) vagy amiloriddal és alacsony káliumtartalmú étrenddel (AML + LK) kezelt egerekben. (B) Hematokrit értékek ugyanazon egereken. (C) A pNCC bősége ugyanazon egerek veséjében.
Ezután teszteltük, hogy az NCC-t közvetlenül extracelluláris [K +] modulálja-e, tenyésztett Flp-In NCC sejtek felhasználásával (14). Az LK táptalajban tenyésztett sejtek nagyobb pNCC-tartalommal rendelkeztek, mint az NK-ban tenyésztett sejtek (3. ábra A). Mivel az LK táptalaj várhatóan hiperpolarizálja a sejteket (21), meghatároztuk a membránpotenciál változásának hatásait a pNCC-re. Szoros összefüggést találtunk a membránfeszültség és a pNCC-bőség között (3. ábra B). Ezután megmutattuk, hogy a K + pNCC-re gyakorolt hatását a 4,4′-diizotiociano-2,2′-stilbenediszulfonsav (DIDS) kloridcsatornát blokkoló gyógyszer blokkolhatja (3. ábra C).
A kálium- és membránfeszültség hatása a tenyésztett sejtek pNCC-jére. (A) Az alacsony K + tápközeg hatása a tenyésztett humán embrionális vese 293 sejtek pNCC-bőségére. (B) A pNCC bőség regressziója a membránfeszültséghez viszonyítva a HEK sejtekben. (C) A kloridcsatornák DIDS-sel történő blokkolásának hatása az alacsony K + tápközeg hatására a HEK sejtekben.
VITA
Ezek az eredmények megmutatják a plazma [K +] domináns szerepét az NCC szabályozásában, és azt jelzik, hogy az extracelluláris [K +] közvetetten befolyásolja az NCC-t az intracelluláris [Cl -] modulálásával. Mivel a DCT a fontos K + szekréciós nephron szegmensek előtt helyezkedik el, az NCC aktivitás fontos hatással lesz a K + kiválasztásra. Az eredmények arra utalnak, hogy az étrendi K + kiegészítés egészségügyi előnyei nagymértékben függenek az NCC-től.
A jelenlegi eredmények megerősítik, hogy az étrendi K + bevitel modulálja a pNCC bőségét, és azt mutatják, hogy az étrendi K + bevitel ebben a tekintetben erősebb, mint az ECF térfogata. Ezek az NCC-re gyakorolt hatások vérnyomás-változásokhoz vezetnek, amelyekhez az NCC aktivitásának modulálása szükséges. Ezeket nagyrészt a plazma [K +] változásai közvetítik, mivel a hatások megismétlődtek, amikor a plazma [K +] -ot megváltoztatták gyógyszerekkel vagy étrenddel, a közelmúltban beszámoltak a K + infúziós kísérletekkel összhangban levő következtetésről (7).
Az eredmények azt mutatják, hogy az extracelluláris [K +], függetlenül a hormonális hatásoktól, közvetlenül modulálja a WNK-SPAK/OxSR1-NCC tengelyt. Sejtmodellünk azt sugallta, hogy a membránfeszültség változásai járnak, mivel a membránfeszültséget megváltoztató manőverek a pNCC bőségében a feszültségfüggéstől függően változást eredményeztek. A bizonyítékok arra is utalnak, hogy a kálium hatásait az intracelluláris klorid koncentrációjának változásai közvetítik.
Széles körben elfogadott, hogy az alacsony NaCl-diéta stimulálja az NCC aktivitását, hozzájárulva a fiziológiailag előnyös NaCl-visszatartáshoz a hormonok, köztük az angiotenzin II és az aldoszteron (22,23) révén. A jelenlegi munka egyre több bizonyítékot mutat be, amelyek azt mutatják, hogy az NCC-t egy LK-diéta is aktiválja, és hogy az LK-diéta NCC-aktivitásra gyakorolt hatásait a HS-bevitel fokozza és fokozza. Bár ez a következtetés ellentmondónak tűnik, egy másik csoport legújabb eredményeit támasztja alá (11). Továbbá valószínűleg annak a megfigyelésnek köszönhető, hogy az étrendi K + nagyobb hatással van az emberek alacsonyabb nyomására a magas - alacsony NaCl-bevitelhez képest (24). Mivel a HS/LK diéta artériás nyomásra gyakorolt hatása hiányzik, amikor az NCC-t genetikailag törölték (2. ábra C), az NCC alapvető és nem redundáns szerepet játszik az étrendi K + vérnyomáscsökkentő hatásában. Mivel dokumentáltuk, hogy az emberek étrendi K + nélkülözése az NCC-t is stimulálja, az eredmények relevánsak az emberi egészség szempontjából, ahol a HS/LK étrendet széles körben úgy gondolják, hogy hozzájárul a hipertónia globális járványához (1,25,26).
Az eredmények azt sugallják, hogy a DCT vese K + szenzorként működik, és a mellékvesével együtt dolgozik a K + homeosztázis megőrzése érdekében. Ebből a szempontból a DCT sejtek és a zona glomerulosa mellékvese sejtjei ugyanazt a jelet, membránfeszültséget érzékelik, de ellentétes irányban reagálnak. A plazma [K +] növekedése serkenti az aldoszteron termelését és felszabadulását a mellékvesében, míg a plazma [K +] növekedése gátolja az NCC-t. A kaliurézis előállításához a mellékvese és a DCT eseményeinek pari passu-nak kell lenniük. Ezt az biztosítja, hogy ugyanaz a jel, extracelluláris [K +] szabályozza mindkét sejttípust. Mivel a mellékvesejtek reagálnak az angiotenzin II ECF térfogatra, a DCT sejtek valószínűleg szintén. Ebben az esetben azonban a két szervben lévő jelek egybehangzóak.
KÖSZÖNETNYILVÁNÍTÁS
Ezt a munkát részben az NIH (DK51496 - DHE és DK54983 - WHW), valamint a Veteránügyi Minisztérium (1I0BX002228–01A1 - DHE) támogatásai finanszírozták. Az AST megkapta az American Heart Association elődoktori ösztöndíját (3PRE14090030). Ezt a munkát az AST végezte el az Oregoni Egészségügyi és Tudományegyetem sejt- és fejlõdési biológiai doktori fokozatának részleges teljesítésében.
Lábjegyzetek
Potenciális összeférhetetlenség: Nincs nyilvánosságra hozva.
VITA
Wolf, Boston: Mi az alacsony és magas magnézium hatása a sejtjeire, mert a magnézium szinte az összes transzportcsatornát érinti, amelyet bemutatott?
Ellison, Portland: Nagy kép szempontjából nem tudom. Ha a DCT-szegmenseket perfundálja, vagy a nephron-szegmenseket alacsony magnéziumtartalommal desztillálja a fürdőben, a sejtek hiperpolarizálódnak. Tehát hatásokat kaphat. A hypomagnesemia minden bizonnyal megnehezítheti a hypokalaemia kijavítását, és hozzájárulhat ehhez is. Tehát ezen gondolkodnom kell.
Wolf, Boston: Van néhány epidemiológiai bizonyíték arra vonatkozóan, hogy a magas magnéziumtartalmú étrend alacsony vagy magas vérnyomással és alacsonyabb kardiovaszkuláris kockázattal jár.
Ellison, Portland: Ez egy nagyszerű kérdés, amire gondolkodnom kell egy kis időt.
Zeidel, Boston: Csak tisztázzuk, hogy van egy sejtje a disztális tekercselt tubulusban, amely elektroneutrális nátrium-klorid bejutással rendelkezik, és hatással van a káliumra. A gondolat az, hogy csökken a szállítás; ha több sót szív fel, akkor kevesebb nátrium jut a gyűjtőcsatornába. Ezért csökkenti a kálium kiválasztását. Mért-e már kloridszintet a disztális tekercselt petesejtekben? Elkezdte elvégezni az ilyen típusú méréseket?
Ellison, Portland: Nem mértük DCT sejtekben in vivo; ezt reméljük. Megmértük a sejtmodellünkben, és ezek egyértelműen befolyásolódnak az általunk előre jelzett módon. Megmutattuk azt is, hogy a sejtekben ezek az alacsony klorid-koncentrációk szükségesek az NCC aktiválásához. Azon dolgozunk, hogy ezt egy fiziológiásabb modellbe helyezzük, de mint tudják, ez nem olyan egyszerű.
Zeidel, Boston: Ha csökkenti a külső káliumszintet és hiperpolarizálja a sejtet, akkor ez a hiperpolarizáció krónikus állapotban van-e, szemben azzal, amit a kultúrában tesz, ahol hirtelen csökkenti a káliumszintet? Azt gondolnám, hogy a sejt alkalmazkodni fog, de talán tévedek.
Ellison, Portland: Mindig úgy gondolunk rá, hogy csak a kálium állítja be a sejtek nyugalmi potenciálját, amitől azt gondolom, hogy krónikusabb. Természetesen a zona glomerulosa-ban vélhetően ez az aldoszteron-szekréció kálium-szabályozásának fő mechanizmusa. Azt hiszem, feltételezzük, hogy stabil marad, de nem tudom, hogy ezt alátámasztanám.
Schuster, New York: Léteznek-e olyan aktiváló mutációk a disztális tekercselt tubulus K-csatornában, amelyek utánoznák ezt a hatást?
Ellison, Portland: A sejtekbe helyezett mutációk olyan mutációk, amelyek Epilepsziát, Ataxiát, Szenzorineurális Süketséget és Tubulopathia Szindrómát (úgynevezett EAST vagy görcsrohamok, Sensorineuralis Süketek, Ataxia, Mentális Retardáció és Elektrolit Kiegyensúlyozatlanság, SeSAME szindróma) okoznak, ami egy szenzoros neuroepilepszia szindróma. De úgy néznek ki, mint a Gitelman-szindróma. Ezeknek a mutációknak olyan hatása van, amely hasonlít a Gitelman-szindrómára. Depolarizálják a sejteket, ezért kikapcsolják a pNCC-t. Nem aktiválják a mutációkat azokban a csatornákban, amelyekről tudom.
Blantz, San Diego: Nagyon sok embert ismerünk, akik a magas nátrium- és alacsony káliumbevitel ellenére sem válnak hipertóniássá. Van-e valamilyen rágcsálókkal kapcsolatos epidemiológiai tanulmánya, amely példát mutat arra, hogy miért nem reagálnak erre az étrendi tápszerre?
Ellison, Portland: Úgy gondolom, hogy ez összhangban áll a Rick Clifton által feltételezett modellel, ahol megmutatta, hogy az NCC vagy az NKCC2 heterozigóta vivőállapotai megakadályozzák - vagy csökkentik a hipertónia kialakulását az egész életen át. Ezek potenciálisan olyan emberek lennének, akik rengeteg sót ehetnek és soha nem lesznek magas vérnyomásukban.
Blantz, San Diego: Van-e olyan génje, amelyet epidemiológiai vagy eredményei alapján kollégái megtalálhatnak, amely az étrendi indiszkréciójuk felszámolására irányít?
Ellison, Portland: Van egy támogatásunk, amelyet Howard Pratt-tal, az Indianai Egyetemen küldtünk be, hogy megpróbáljuk megvizsgálni ezeket a dolgokat, de nem tudom, hogy ez még megtörtént-e.
Luke, Cincinnati: Bizonyíték van arra, hogy alacsony sótartalmú étrend esetén a káliumváltozások sokkal kevésbé befolyásolják a vérnyomást, mint magas sótartalmú étrend esetén. Amikor alacsony sótartalmú étrendet használ, a káliumterhelés nem gyakorol akkora hatást a vérnyomásra, ami továbbra is hangsúlyozza a só fontosságát az extracelluláris térfogat szempontjából. Tehát amire összpontosítanunk kell, az a magas kálium/alacsony sótartalmú étrend. Egyetért-e ezzel?
Ellison, Portland: Igen.
Luke, Cincinnati: És nem tudjuk, milyen alacsonyra kell mennie a sónak. Úgy értem, ez teljesen világos. Lehet, hogy az amerikai szív túl messzire ment 1,5 grammal. De nem hiszem, hogy el kellene felejtenünk a történetet, és talán még egy kicsit hangsúlyoznunk kell a káliumot, és a DASH diéta ezt is megcsinálja. A nátrium-klorid töltés nagyon különbözik a nátrium-hidrogén-karbonát töltéstől, ami megint azt gondolom, hogy alátámasztja a hipotézist.
Ellison, Portland: Igen. Köszönöm ezeket a megjegyzéseket.
- A vércsoport-diéták áttekintése Egyél a típusodnak Townsend-levél orvosoknak
- A Varanasis Chhappan Bhog tök csökkenti a vérnyomást és az elhízást - mégis kipróbálta az NDTV ételt
- A vércsoport tíz energiát fokozó szuperélelmiszert fogyaszt az Ön típusának
- Mit; s a megfelelő étrend magas vérnyomás esetén DR
- Vegye le a magas vérnyomást Hogyan csökkenthető a magas vérnyomás