Kolin
A kolin (trimetil-β-hidroxi-etil-ammónium) egy kvaterner ammóniumvegyület, amelynek összetett szerepe van a különféle fontos neurokémiai folyamatokban.
Kapcsolódó kifejezések:
- Mágneses rezonancia képalkotás
- Eicosanoid Receptor
- Acetilkolin
- Enzimek
- Metionin
- Kreatin
- Inozit
- Lipid
- Fehérje
- Sejt membrán
Letöltés PDF formátumban
Erről az oldalról
Aminosavak és nitrogénvegyületek
Emésztés és felszívódás
A kolintartalmú foszfolipideket hasnyálmirigy-foszfolipáz A2 hasítja (EC3.1.1.4), és a kapott lizofoszfatidil-kolint (amely kevert micellák részévé válik) felveszik a vékonybél enterocitájába.
A szabad kolint mediált transzport és diffúzió veszi fel a vékonybél mentén (Zeisel, 1994). A 2-es kationos aminosav transzporter (CAT-2, y +, SLC7A2) a vékonybél kefe határában expresszálódik, és specifikusan közvetíti a kolin enterocitákba történő felvételét. Az abszorbeált kolin nagy része beépül a foszfolipidekbe, és a chilomikronokkal szekretálódik a nyirokba.
A lizofoszfolipáz (EC3.1.1.5) hasítja a lizofoszfatidilkolint, majd a gliceril-foszfokolin-foszfodiészteráz (EC3.1.4.2) végül felszabadítja a kolint. A szabad kolin exportja a bazolaterális membránokon még nem jól ismert. A betainfelvétel a bél lumenéből szintén további vizsgálatot igényel. A csibéknél kiderült, hogy nátriumfüggő és nátriumfüggetlen komponenseket tartalmaz (Kettunen et al., 2001).
Megjegyzés: A bélbaktériumok a bevitt kolin és kolin-foszfolipidek jelentős részét lebontják betainzá és trimetil-aminná (TMA). A betain és a TMA is felszívódik. A flavintartalmú monooxigenáz (FMO, EC1.14.13.8) N-oxidálja a TMA-t. A máj metabolizmusáért felelős fő izoform az FMO3 (Treacy et al., 1998). Az FMO2 kisebb mértékben járul hozzá. A testszagú feltételezett személyek közel 4% -ánál súlyos TMA N-oxidáció (halszag-szindróma) károsodott. Szüleiknél az FMO-aktivitás kevésbé kifejezett (de mégis észrevehető) csökkenése volt (Ayesh et al., 1993).
CHOLINE | Fiziológia
Összegzés
A kolin az étrendben számos okból fontos. Ahogy egyre jobban megértjük a folát- és a homocisztein-táplálkozás fontosságát, fokozott érdeklődést kell tanúsítani a kolin kölcsönhatásában a folát- és a homocisztein-anyagcserével. Az agy fejlődésében a kolinnal kapcsolatos legújabb megállapításoknak ösztönözniük kell az emberekkel végzett hasonló vizsgálatokat. A következő néhány évben valószínűleg rendelkezésre állnak élelmiszerek összetételére vonatkozó adatok a kolinra vonatkozóan, és ez lehetővé teszi a kolin, a folát és a metionin kölcsönhatásainak vizsgálatát az epidemiológiai adatok figyelembevételével. Ezenkívül többet kellene megtudnunk a nők kolinigényéről. Ezen okok miatt fenn kell tartani az érdeklődést a kolin iránt, mint ember tápanyagát.
CHOLINE | Tulajdonságok és meghatározás
Háttér
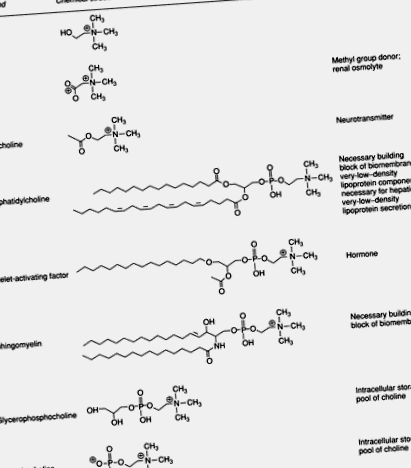
A kolin az élelmiszerek gyakori alkotóeleme, és alapvető eleme az emberi étrendnek. Ez a kvaterner amin fontos a sejtmembránok szerkezeti integritása és jelátviteli funkciói szempontjából; az étrendben a metilcsoportok fő forrása; közvetlenül befolyásolja a kolinerg neurotranszmissziót; és a lipid transzporthoz/anyagcseréhez szükséges. Az emberi szövetekben a legtöbb kolin foszfolipidekben található meg, mint például a foszfatidilkolin és a szfingomielin. Bizonyos összetevőkben, például az emberi tejben, a kolin-észterek a foszfo-kolin és a glicerofoszfo-kolin a kolin domináns formái. Bár a teljes kolinállomány kisebb hányadát képviselik, a kolin fontos metabolitjai közé tartozik a vérlemezkéket aktiváló faktor, az acetilkolin, a kolin plazmalogének, a lizofoszfatidilkolin és a betain (1. ábra).
1.ábra . A kolin biológiailag fontos metabolitjai.
Vitaminok
1 kolin
A kolin különösen figyelemre méltó, mert kulcsszerepet játszik a metilcsoport anyagcseréjében, a karcinogenezisben és a lipid transzportban, mint a lecitin alkotóeleme (Garrow, 2007). A kolint általában elegendő mennyiségben termelik; fiatal növekvő állatokban azonban pozitív növekedési reakció léphet fel kolin hozzáadásával, amely kereskedelmi forgalomban kapható trimetil-hidroxi-etil-ammónium-kloridként vagy bitartarátként. A diétához általában kolint adnak, hogy csökkentse a metionin által szolgáltatott aktivált metilcsoportok szükségességét. Ezekhez a metilcsoportokhoz gazdaságosabb kolint adni, mint metionint.
A kolin az acetilkolin egyik előfutára. A kolin a szfingomyelin és a lecitin alkotóeleme is. A betain kolinból történő képződése a labilis metilcsoportok fontos forrása a transzmetilezési reakciókhoz. A kolint de novo szintetizálhatjuk etanol-aminból is, ha a metionin vagy a dimetil-cisztein, vagy a betain megfelelő mennyiségben van. Az étrendben a leggyakoribb kolinforrás a lecitin. A kolinhiány elsődleges jele a zsírmáj. Majmokban, kutyákban, macskákban és patkányokban azt is kimutatták, hogy a tartós kolinhiány cirrhózist eredményez. Egerekben és patkányokban a hosszan tartó hiány végül hepatocelluláris rákot eredményez, ami egyedülálló példa a táplálékhiányra, amely neoplazmát eredményez. Étrend kilogrammjára gyakran ötszáz és 1000 mg kolint adnak (Garrow, 2007).
Kolin és foszfatidilkolin
Bélfelszívódás
A szabad kolint és a kolintartalmú foszfolipideket többféle mechanizmus révén szívják fel a belekben. A szabad kolin egy részét a bélbaktériumok betainzá metabolizálják, majd az aktív Na + és Cl - kapcsolt transzport rendszerek és egy passzív Na + -független transzport rendszer segítségével felszívódnak. A fennmaradó szabad kolin egy vivő által közvetített transzport segítségével felszívódik az enterocitákban. A kolintartalmú foszfolipideket (beleértve a foszfatidilkolint is) először hasnyálmirigy enzimek és a bél nyálkahártya sejtjeiből származó lipázok hidrolizálják, felszabadítva a kolin molekulát a foszfolipid gerincéből. A foszfolipidekből származó kolin biohasznosulása az emésztőrendszer fiziológiájában mutatkozó különbségek miatt gyermekeknél eltér a felnőttektől. Mivel az újszülöttek szinte kizárólag az anyatejre vagy tápszerre támaszkodnak, a kolintartalom és annak tejben való biológiai hozzáférhetősége alapvető tényező az ajánlott kolinbevitel eléréséhez az élet első 6 hónapjában (1. táblázat).
Asztal 1 . Diétás kolin megfelelő bevitel, felső határok és a túlpótlás káros hatásai
| Csecsemők és gyermekek | 0–6 hónap | 125 | Nincs megállapítva | Halszagú testszag, hányinger és hasmenés (150 mg kg −1 nap −1 és feljebb) |
| 7–12 hónap | 150 | Nincs megállapítva | ||
| 1–3 év | 200 | 1 | Gyomor-bélrendszeri irritáció, hányás, könnyezés és étvágytalanság (8 g nap –1 és több) | |
| 4–8 év | 250 | 1 | ||
| 9–13 év | 375 | 2 | Homályos látás (9 g nap, -1 és több) | |
| Fiúk | 14–18 év | 550 | 3 | |
| Lányok | 14–18 év | 400 | 3 | |
| Terhes nők | Minden korosztály | 450 | 14–18 év: 3 g | |
| 19 éves és idősebb: 3,5 g | ||||
| Szoptató nők | Minden korosztály | 550 | 14–18 év: 3 g | |
| 19 éves és idősebb: 3,5 g | ||||
| Más férfiak | 550 | 3.5 | ||
| Más nők | 425 | 3.5 |
Tojás kolin
A kolint alapvető tápanyagként 1999-ben hozták létre, az ajánlott napi bevitellel (RDI) a férfiaknál 550 mg d -1, a nőknél 450 mg d -1 adagot. A kolin RDI-je nő a terhesség és a szoptatás ideje alatt az anyától a magzatig és az anyatejbe történő magas kolintranszfer miatt. Állatkísérletek azt mutatják, hogy a kolin alapvető szerepet játszik az agy fejlődésében, különösen a memóriaközpontok, a magzat és az újszülött fejlődésében. A legújabb vizsgálatok azt mutatták, hogy a magasabb kolin bevitel az idegcső hibáinak csökkent kockázatával, a gyulladás plazma markereinek csökkenésével és az emlőrák kockázatának csökkenésével jár. Tanulmányok azt is kimutatták, hogy az Egyesült Államokban a felnőtt férfiak és nők kevesebb mint 10% -a éri el a kolin számára ajánlott AI-t, köztük csak 10-ből terhes nő. A tojássárgája lecitin (foszfotidilkolin) kiváló diétás kolinforrás, amely nagy tojásonként 125 mg kolint ad, és napi egy tojás hozzáadása az étrendhez jelentősen növelheti a megfelelő bevitelű felnőttek számát.
A patofiziológiai szerepek és a biomarkerek klinikai jelentősége akut koszorúér szindrómában
Cangel Pui-yee Chan, Timothy Hudson Rainer, a klinikai kémia fejlődésében, 2013
7.1 Kolin
A kolin vízoldható szerves vegyület, amelynek molekulatömege 104,17 g/mol. Az Orvostudományi Intézet Élelmezési és Táplálkozási Tanácsa alapvető tápanyagnak minősítette [85]. Részt vesz a foszfolipidek és a sejtmembránok egyéb szerkezeti komponenseinek szintézisében, valamint a fontos neurotranszmitter acetilkolin előfutáraként [86]. Az emberek kis mennyiségben szintetizálhatják a kolint azáltal, hogy a foszfolipidet, a foszfatidil-etanol-amint de novo szintézissel foszfatidilkolinná alakítják. Azonban az emberek nem tudnak annyi kolint szintetizálni, hogy kielégítsék az anyagcserét. A diéta révén elegendő mennyiségű kolin nyerhető.
További vizsgálatokra van szükség annak klinikai jelentőségének vizsgálatához ACS-gyanús betegeknél. A kolint szintén nagy teljesítményű folyadékkromatográfia-tömegspektrometriával határozzák meg, ami megnehezíti a rutinszerű klinikai használatba vételét. Gyors és egyszerű vizsgálat kidolgozása szükséges annak értékeléséhez, hogy a kolin képes-e azonosítani a magas kockázatú betegeket a klinikai gyakorlatban.
Agy- és idegrendszer: biológia, anyagcsere és táplálkozási követelmények
Kolin
Mezőgazdasági és kapcsolódó biotechnológiák
4.57.6.1. Kolin
A kolinkötő fehérjék szerkezete és működése
Sergio Galán-Bartual,. Juan A. Hermoso, Streptococcus Pneumoniae, 2015
A CBR szerkezeti plaszticitása: Funkcionális következmények
A CBR-ek általában egy ββ-3 szolenoidban vannak elrendezve, amely 120 ° -os óramutató járásával ellentétes irányú forgásirányú superhelix elrendezést mutat. Ez a szerkezeti elrendezés független a kolin stabilizálásában részt vevő aromás csoportok számától. Az ismétlésen belüli mutációk és/vagy beillesztések azonban befolyásolják a szuperhelikus geometriát, kizárják a kolinkötést, és elősegítik a CBP-k specifikus strukturális változásait, amelyek kritikusak sajátos funkciójuk szempontjából. Az LytC p10 ismétlésében egy extra β-szál töltéses maradékokkal való jelenléte háromszálú anti-párhuzamos β-lapot hoz létre, amely megszakítja a szuperhélix forgását. A p11 ismétlés szintén megváltoztatja szerkezetét, elősegítve a katalitikus domén stabilizálódását és aktív helyét a CBM felé orientálva, ami a LytC jellegzetes horogszerű konformációját eredményezi (11.3F ábra), amely kritikus a fiziológiai funkciójában (lásd: Autolysin LytC ”szakasz).
11.3. Ábra A CBP-k háromdimenziós struktúrái.
(A) Teljes hosszúságú Pce szalagdiagramja (2BIB PDB kód), amely a CBM-t lila színnel, a katalitikus modult narancssárgával és a linkert mutatja zöld színnel. A kolin-analógokat zöld gömbökként ábrázolják, a C-LytA fázisozásához használt (2,2 ': 6', 2'-terpiridin) -platinát (II) cián gömbökként ábrázolják. Ez a színkód minden panelen megmarad. A reakciótermékeket (PC) az aktív helyen sárga gömbökként ábrázolják. (B) A CbpM kristályszerkezete (3HIA PDB kód). (C) A CbpA R2 doménjének háromdimenziós szerkezete (1W9R PDB kód). (D) A CbpF szalagdiagramja a CBM-mel lila, a linker domén cián és az N-terminális domén narancssárga (PDB 2V04 bejegyzés). A konszenzus (p1 – p5) és a nem konszenzusos (dp1 – dp6) CBR-eket jelöljük. (E) A LytA CBM (C-LytA) (PDB 1HCX bejegyzés) és a LytA katalitikus moduljának (4IVV PDB kód) háromdimenziós szerkezete. A dimer elrendezés kristálytani és SAXS vizsgálatokon alapszik [53]. (F) A pneumococcus autolysin LytC háromdimenziós szerkezete (PDB 2WWD bejegyzés). A különböző szerkezeti elrendezést mutató p10 és p11 ismétlések cián színnel vannak ellátva. (G) Az LytB katalitikus moduljának háromdimenziós szerkezete. A 73-as glikozid-hidroláz modul narancssárga színű, a WW modul cián, az SH3b modul pedig sötétkék. (H) A PspA LB doménjének szerkezete.
A CbpF-ben a kanonikus ismétlésekbe történő beillesztések teljesen más háromdimenziós struktúrát eredményeznek. N-terminális doménjét hat nem konszenzusos CBR építi fel, amely egy lemez alakú konformációt biztosít ehhez a doménhez (11.3D ábra), amely kulcsfontosságú a szabályozó szerepében (lásd: „Kolin-kötő fehérje F” szakasz). Egy másik szerkezeti eltérés figyelhető meg a Cpl-1-ben, a Cp-1 pneumococcus fág által kódolt CBP-ben, amelyben az utolsó két ismétlés (p5 és p6 néven) a C-terminális farokkal együtt meghosszabbított hatszálú β -lap, amely megakadályozza a kolin megkötését és elősegíti az intermoduláris kölcsönhatásokat a katalitikus doménnel (11.4A. ábra).
11.4. Ábra A fág CBP-k háromdimenziós struktúrái.
(A) A teljes hosszúságú Cpl-1 endolizin háromdimenziós szerkezete kolinnal (zöld gömbökkel) komplexben (PDO kód: 1OBA). A lizozim modul (GH25 család) narancssárgával, a linker ciánnal, a CBM pedig ibolyával színezett. Az első négy ismétlést (p1 – p4) szuperhelikus elrendezésben hajtják végre, lehetővé téve a kolin megkötését, míg a végső ismétléseket (p5 – p6) és a C-terminális farokot egy hatszálú β-lap hajtja össze, amely intermoduláris interakciókat tesz lehetővé a katalitikus modul. (B) A fág LytA-szerű fehérje CBM szerkezete (PDB kód: 4IWT). Amint azt a LytA-ban megfigyeltük, a CBM egy dimert képez a C-terminális ismétlések kölcsönhatása révén. Kolinmolekulák ábrázolva pálcákban.
Bár a CBR-ek fő szerepe a kolinkötés, az eddig közölt strukturális példák nagy plaszticitást mutatnak ezekre az ismétlésekre, ezáltal különböző strukturális és funkcionális szerepeket tesznek lehetővé az egyes CBP-kben.
- Endokrin betegség - áttekintés a ScienceDirect témákról
- Élelmiszer utáni vágy - áttekintés a ScienceDirect témákról
- Húskonzerv - áttekintés a ScienceDirect témákról
- Az elhízás szövődményei - áttekintés a ScienceDirect témákról
- Szénhidrátok az emberi táplálkozásban - áttekintés a ScienceDirect témákról