Bélnyálkahártya
Kapcsolódó kifejezések:
- T sejtek
- Peptid
- Immunglobulin A
- Beágyazott gén
- Baktérium
- Szekréció (folyamat)
- Lárva
- Mucosa
- Lamina Propria
Letöltés PDF formátumban
Erről az oldalról
Női egészségügyi problémák és illegális tasak műtét
Kismedencei sugárzás és tasak funkció
A bélnyálkahártya, beleértve a vékonybél és a vastagbél nyálkahártyáját, valamint az ileális tasak, sugárkárosodásnak van kitéve. A szerző csoportja kimutatta, hogy az UC-vel összefüggő vastagbélrák sugárterápiájában szenvedő betegeknél a kismedencei tasak építése előtt krónikus antibiotikum-refrakter pouchitis alakulhat ki [80]. Feltételezzük, hogy a tasak működését a kismedencei sugárkezelés is befolyásolhatja nőgyógyászati rosszindulatú daganatok esetén. Ezenkívül a sugárzással összefüggő pouchitist nehéz kezelni [85]. Ezért a nőgyógyászati rosszindulatú daganatos betegeknél a sugárkezelés onkológiai és GI-kockázatait és előnyeit gondosan ki kell egyensúlyozni.
Nyálkahártya immunitás
Alejo Chorny,. Cerutti Andrea, az immunológia fejlődésében, 2010
1.1 Bélbaktériumok
A hasmenés kezelése
A hasmenés kórélettana és az ORS alakulása
A nanotoxikológia alapelvei
Ashok K. Singh PhD, in Engineered Nanoparticles, 2016
6.1.2.3 Bélnyálkahártya-gát (19. ábra (C))
A bélnyálkahártya méretfüggő módon korlátozza a nanorészecskéket a paracelluláris vagy a transzcelluláris útvonalra. A nyálkahártya felvétele a nanométeres tartományokban a leghatékonyabb, és akkor akadályozott, ha a méret meghaladja az 1 μm-t. A molekulák paracelluláris diffúziójának fő akadálya a bélhámon keresztül a szoros csomópont vagy a zonula occludens régiója. Amint a 19. (C) ábrán látható, a nyálkahártya-gát egy nyákrétegből, vizes rétegből, hámsejtekből, bazális membránból és kapillárisokból áll, amelyek korlátozzák a nanorészecskék behatolását a bélből a vérkapillárisokba.
Bélhez kapcsolódó limfoid szövetek kialakulása
Melanie Flach, Andreas Diefenbach, Nyálkahártya immunológia (negyedik kiadás), 2015
A bélnyálkahártya az egyik legnagyobb és leginkább kitett testfelületünk, így létfontosságú igényt teremt a hatékony immunválaszra. Ezek összehangolása érdekében a nyálkahártya immunrendszere számos szervezett limfoid struktúrát tartalmaz; a legjobban tanulmányozottak a mesenterialis nyirokcsomók, a Peyer-foltok, a kriptopatchok és az elszigetelt lymphoid tüszők. Fejlesztési követelményeik és időkereteik bizonyos mértékben átfedik egymást, de sok szempontból nagyon eltérőek. Ezenkívül számos környezeti hatás is befolyásolhatja őket, például az élelmiszer vagy a bél mikrobiota. A következő fejezetben megpróbálunk némi megvilágítást adni azokról a folyamatokról, amelyek a bélrendszer nyirokszerkezeteinek kialakulása során következnek be.
A VIZSGÁLATI BIOTRANSZFORMÁCIÓ ALKALMAZÁSA A TÁPLÁLKOZÁSI VÁLTOZÁSHOZ
BEVEZETÉS
Korábbi tanulmányokban a táplálkozási koleszterin és a zsírsavak, valamint az étkezési lipidek összetételének változása megállapította, hogy módosítja a bél gyógyszer metabolizmusát (Hietanen és Laitinen 1977, 1978, Hietanen és mtsai 1975). A bél UDP glükuronoziltranszferáz enzim érzékeny az étkezési fehérjetartalom változására (Hietanen és Lang 1978).
Jelen tanulmány további célja a táplálkozási tényezők vizsgálata volt, amelyek fontosak lehetnek a bél gyógyszer metabolizmusának szabályozásában. Ebben a tekintetben értékelték az étrendi fehérjetartalom hatását a monooxigenáz-reakciók indukálhatóságára, az epoxid-hidráz és az UDP-glükuronozil-transzferáz aktivitásra. Mivel ismert, hogy a vitaminok az oxidatív enzimek kofaktoraként működhetnek, a riboflavin hatását a nyálkahártya oxidatív enzimjeire és az UDP glükuronoziltranszferáz aktivitását az étrendi riboflavin tartalom módosításával is értékelték.
Enterális neuroimmun kölcsönhatások
B Titkosító komponens
A bélnyálkahártyát olyan szekretomotoros idegsejtek innerválják, amelyek sejtteste a submucous plexus ganglionjaiban található. Ezek az idegsejtek, amelyek morfológiájúak a Dogiel I. típusú enterális idegsejtekkel (Bornstein és Furness, 1988), a végső közös utak az enterális idegrendszer integratív mikrokeringéseitől a nyálkahártya szekréciós sejtjeihez (1. ábra). A szekretomotoros neuronok az acetilkolin vagy vazoaktív bélpeptid (VIP) felszabadításával serkentik a szekréciót, amelyek az enterociták muszkarinos kolinerg vagy VIPerg receptorain hatnak (Cooke, 1986, 1989).
A szubmukózus szekretomotoros neuronok aktiválása a kloridionok aktív szekrécióját idézi elő a bél nyálkahártyájából. Ezt megerősíti a Ussing fluxus kamrákban rögzített rövidzárlati áramválaszok kísérleti manipulálása és az izotóppal jelzett klorid transzmukozális mozgásának mérése (Cooke, 1986, 1989). Bár a kísérleti meghatározások általában kloridra korlátozódnak, valószínű, hogy a fiziológiás szekréciós válasz nátrium-kloridból, vízből és mukoproteinekből áll.
Az antigén alkalmazása az Ussing-kamrákba szerelt érzékenyített bélre hasonló szekréciós választ eredményez, mint a szubmukózus szekretomotoros neuronok aktiválásával (Perdue és Gall, 1986; Perdue és mtsai., 1990; Baird és Cuthbert, 1987; Harari és mtsai.). (1987; Castro, 1989). Ezeket a válaszokat neuronális blokkolás elnyomja, jelezve, hogy az antigén érzékelése a szekréciót szabályozó idegi mechanizmusok aktiválásához vezet. Amint arra már rámutattunk, és amint ezt a fejezet később részletezi, az idegi mechanizmusok felelősek a mozgás és a szekréciós aktivitás közötti koordinációért és hatékony időzítésért, mivel a bél reagál a fenyegető antigén megjelenésére a lumenében.
A lisztérzékenység szerológiai és nyálkahártya immunológiai alapjai
Per Brandtzaeg,. Helge Scott, a bél immunfiziológiájában, 1993
1 Szekréciós immunglobulinok előállítása és szállítása
A bélnyálkahártya mennyiségileg a humorális immunitás legfontosabb mediátor szerve, és egyedi szekréciós antitesteket alkalmaz, csakúgy, mint az összes többi exokrin szövet. A szekréciós antitestek képződését részben az IgA-termelő blasztok és a plazmasejtek szembetűnő nyálkahártya-túlsúlya (80–90%) magyarázza nyilvánvaló gyulladás hiányában. Az emberi vékonybél méterében általában körülbelül 1010 ilyen immunocita található (Brandtzaeg et al., 1987). A bél teljes hosszát figyelembe véve, durva becslés azt mutatja, hogy a test összes Ig-termelő sejtjének körülbelül 80% -a a bél nyálkahártyájában található (Brandtzaeg et al., 1989a).
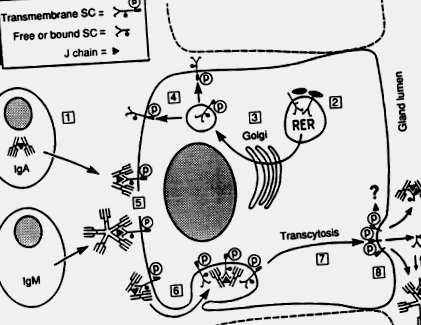
Immunglobulin A szekréciós helyeken található immunociták, például a bél lamina propria, főleg dimereket és nagyobb polimereket termelnek, amelyek diszulfidhoz kapcsolt polipeptidet neveznek, az úgynevezett „csatlakozó” vagy J láncot, amely rendszeresen előfordul a pentamer IgM-ben is (Brandtzaeg, 1985; Mestecky és McGhee, 1987 ). A polimer IgA-t (poli-IgA) a mirigyes epitheliumon keresztül szállítják az IgM-mel együtt egy epitheliális transzmembrán fehérjén keresztül, amelyet szekréciós komponensnek (SC) vagy poli-Ig receptornak neveznek (1. ábra). Az emberi SC az Ig szupergén családjába tartozik; teljes cDNS-jét nemrégiben klónozták, és génje az 1. kromoszóma hosszú karján található (Krajči et al., 1991).
1. ábra . Modell a szekréciós IgA (SIgA) és a szekréciós IgM (SIgM) helyi előállításához. (1) J-láncot tartalmazó poli-IgA és pentamer IgM termelése nyálkahártya plazma sejtek által. (2) A transzmembrán szekréciós komponens (SC) vagy a poli-Ig receptor szintézise és magglikozilezése (-) a szekréciós hámsejt durva endoplazmatikus retikulumában (RER). (3) Terminális glikozilezés (•) a Golgi-komplexben. (4) Foszforilezés (P) néhány későbbi lépésben. (5) Az SC komplexezése J-láncot tartalmazó poli-Ig-vel a bazolaterális sejtmembránon. (6) A komplexek és a nem foglalt SC endocitózisa. (7) A vezikulák transzcitózisa. (8) A transzmembrán SC hasítása és az SIgA, SIgM és a felesleges szabad SC elengedése. A transzmembrán SC hasítási mechanizmusa és a citoplazmatikus farka sorsa ismeretlen (?). A külső transzlokáció során az IgA-SC komplexek kovalens stabilizációja rendszeresen bekövetkezik (két diszulfid híd jelzett SIgA-ban az SC és az egyik IgA alegység között), míg a szekrécióban lévő szabad SC felesleg a nem kovalens IgM-SC komplexek stabilizálására szolgál. (dinamikus egyensúly SIGM-re jelezve).
Adaptálva Brandtzaeg et al. (1988)
A J-lánc kulcsfontosságú az Ig-polimerek SC-kötőhelye szempontjából (Brandtzaeg, 1985), ezért kulcsfontosságú tényező a szekréciós IgA (SIgA) és szekréciós IgM (SIgM) antitestek képződésében. A figyelemre méltó SC-függő hámtranszport-mechanizmus felelős azért, hogy naponta több SIgA kerüljön a bél lumenébe, mint a test napi IgG-termelése (Conley és Delacroix, 1987).
Nyálkahártya makrofágok a védelemben és a szabályozásban
Lesley E. Smythies,. Phillip D. Smith, a Nyálkahártya immunológia (negyedik kiadás), 2015
Absztrakt
A bélnyálkahártya a test legnagyobb makrofágtartalmát tartalmazza. A bél makrofágok keringő vérmonocitákból származnak, amelyek kizárólag a lamina propriában lokalizálódnak, ahol bizonyos felszíni antigéneket és receptorokat veszítenek, beleértve a CD11a – c, CD14 és FcRI-III, de megtartják a HLA-DR, CD13 és TLR3, 5–9. A CD11a és b hiánya az emberi bél makrofágjain segít megkülönböztetni ezeket a sejteket a bél myeloid dendritikus sejtjeitől. Az emberi bél makrofágok különálló fenotípusa, amelyet a CX3CR1 hiánya tükröz, kihívást jelent az emberi és az egér nyálkahártya makrofágjainak közvetlen összehasonlítására egyetlen közös felületi antigén alapján. A rezidens emberi bél makrofágok hatékonyan csökkentik a szabályozó citokinek, például az IL-10 és az összes gyulladásos citokin (gyulladásos allergia) termelését a sztróma TGF által közvetített Smad jelátvitel és az NF-B inaktiváció révén, de erőteljes fagocita és mikrobicid aktivitást tartanak fenn. Így az emberi bél makrofágjai megtisztítják a helyi apoptotikus sejteket, és védelmet nyújtanak a mikrobák ellen, amelyek nem gyulladásos módon törik meg a hámot, ezáltal hozzájárulva a nyálkahártya homeosztázisához.
Emésztőrendszeri toxikológia
10.08.1.4 A xenobiotikumok metabolizmusa Mucosa által
A xenobiotikumokat metabolizáló bélnyálkahártya-enzimek megakadályozhatják számos potenciálisan toxikus anyag szisztémás felszívódását. Például számos peptidet, amelyeknek mély biológiai hatása lehet, a nyálkahártya enzimjei metabolizálják azok felszívódása előtt. Hasonlóképpen sok észter hidrolizálódik a villus hámsejtjeiben található észterázokkal való kölcsönhatás révén. Néhány elfogyasztott alkoholt a gyomor nyálkahártyájában található gyomor-alkohol-dehidrogenáz metabolizál, az alkohol szisztémás felszívódása előtt. Míg a gyomornyálkahártya anyagcseréje valószínűleg kevéssé járul hozzá az általános alkohol-anyagcseréhez, a gyomor-alkohol-dehidrogenáz aktivitását a gyógyszerek és a krónikus alkoholfogyasztás befolyásolják (Julkunen et al. 1985).
Mint fent említettük, a xenobiotikus anyagcserét luminalis mikroorganizmusok hajthatják végre, továbbá a luminalis organizmusok befolyásolhatják a nyálkahártya enzimaktivitását. A bél mikroflóra metabolikus aktivitását befolyásoló tényezőket figyelembe kell venni a szájon át bevitt xenobiotikumok biotranszformációjának vizsgálatakor (Rowland 1988). Például jelentős különbségek vannak a különböző állatfajok bélflóra mikrobiális összetételében és metabolizmusában. A mikrobiális populációt befolyásolhatja az életkor, és valószínűleg nagyon fiatal és nagyon idős korban fog eltérni. A környezeti tényezők, például a gyógyszerek (különösen az antibiotikumok), az étrend és a xenobiotikumok módosíthatják az idegen vegyületek mikrobiális anyagcseréjét, és ezáltal a toxicitást.
- Liver Fluke - áttekintés a ScienceDirect témákról
- Kefir - áttekintés a ScienceDirect témákról
- Kemény széklet - áttekintés a ScienceDirect témákról
- Máj policisztás betegség - áttekintés a ScienceDirect témákról
- Inzulinrezisztencia - áttekintés a ScienceDirect témákról