Az FDA jóváhagyta a Maestro elektronikus fogyókúrás készüléket
Az FDA jóváhagyta a Maestro újratölthető rendszert az elhízás kezelésére…
A Maestro újratölthető rendszer legalább 18 éves, 35–45-es BMI-vel rendelkező betegek kezelésére javallt, legalább egy, az elhízással összefüggő állapotban, és akiknek a súlycsökkentő program során nem sikerült lefogyniuk.
A sajtóközlemény szerint az új eszköz elsőként célozza meg az agy és a gyomor közötti idegpályát, amely ellenőrzi az éhséget és a jóllakottságot.
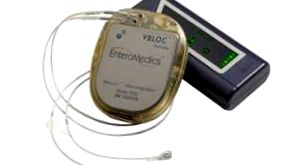
A betegek tölthetik az eszközt, az egészségügyi szolgáltatók pedig külső vezérlőkön keresztül módosíthatják annak beállításait.
Az FDA jóváhagyta a biztonságosságot és a hatásosságot értékelő klinikai vizsgálatot, amely 233, legalább 35 BMI-s beteget vett fel. A kutatók 157, aktív Maestro-eszközt kapó beteg súlycsökkenését és nemkívánatos eseményeit hasonlították össze 76 olyan beteggel, akik olyan készüléket kaptak, amely nem volt aktiválva.
Az eredmények azt mutatták, hogy az aktív eszközcsoport 12 hónap elteltével 8,5% -kal többet vesztett a felesleges testtömegből, mint a kontroll csoporthoz. Továbbá az aktív eszközcsoport 52,5% -a vesztette súlyfeleslegének legalább 20% -át, 38,3% -a pedig legalább 25% -át.
A klinikai vizsgálat során jelentett súlyos mellékhatások között hányinger, fájdalom a neuroregulátor helyén, hányás és műtéti szövődmények voltak. Ezenkívül néhány beteg fájdalmat, gyomorégést, nyelési problémákat, böfögést, enyhe hányingert és mellkasi fájdalmat tapasztalt.
Bár a vizsgálat nem tudta elérni a túlsúlycsökkenés elsődleges végpontját, amely legalább 10% -kal több, mint a Maestro rendszerű kontrollcsoporté, az FDA tanácsadó bizottsága úgy döntött, hogy a 18 hónapos adatok tartós fogyást mutatnak az eszközzel. Ezért a testület tagjai egyetértettek abban, hogy az eszköz előnyei meghaladják a kockázatokat azoknál a betegeknél, akik számára az eszköz javasolt.
A klinikai vizsgálat eredményei mellett az FDA figyelembe vette az ügynökségek által támogatott felmérés válaszait az elhízási eszközök betegpreferenciáiról. Az eredmények azt mutatták, hogy a betegek egy csoportja elfogadja az eszközzel járó kockázatokat a fogyás várható mennyisége esetén.
Az ügynökség egy jóváhagyás utáni ötéves vizsgálatot követel meg, amely legalább 100 beteget követ, hogy további adatokat gyűjtsön a biztonságról és a hatékonyságról, mint a jóváhagyás feltételeiről.
Gyöngy gyakorlása:
- A Maestro legalább 18 éves, 35–45-es BMI-vel rendelkező betegek kezelésére javallt, legalább egy elhízással összefüggő állapotban, és akiknek nem sikerült lefogyniuk egy fogyókúrás program keretében.
- Az eredmények azt mutatták, hogy az aktív eszközcsoport 12 hónap elteltével 8,5% -kal többet vesztett a felesleges testtömegből, mint a kontroll csoporthoz.
- A klinikai vizsgálat során jelentett súlyos mellékhatások között hányinger, fájdalom a neuroregulátor helyén, hányás és műtéti szövődmények voltak.
Ikramuddin S, Blackston RP, Brancastisano A és mtsai. A reverzibilis intermittáló intraabdominális vagalis idegi blokád hatása a kóros elhízásra: a ReCharge randomizált klinikai vizsgálat. JAMA. 2014 szeptember 3; 312 (9): 915-22
- Az FDA jóváhagyja a cukorbetegséget és a fogyást segítő gyógyszereket
- Az FDA jóváhagyja a cukorbetegség gyógyszerét, amely a fogyáshoz is hozzájárul
- Az FDA jóváhagyja a fogyást segítő új gélt; CBS New York
- Az FDA jóváhagyja az Ozempic-et, a cukorbetegséget, amely szintén segít a fogyásban - CBS News
- Az FDA jóváhagyta az új fogyókúrás tablettákat - működik-e az Utah Egyetem Egészségügyi