Az aromatáz-gátlás javítja az elhízott nőknél talált csökkent LH-kibocsátást
Absztrakt
Bevezetés
Az elhízás megnehezíti a nők fogantatását, akár természetes, akár segített módszerekkel. Az elhízásról ismert, hogy befolyásolja a hipotalamusz-hipofízis-petefészek tengelyt, a petesejtek minőségét és az általános termékenységet [1,2,3]. Mivel a fejlett országokban az elhízás gyakorisága meghaladja az 50% -ot, fontos megérteni a patofiziológiát és a beavatkozás lehetséges módjait [3].
A luteinizáló hormont (LH) az agyalapi mirigy gonadotropjai termelik, és elengedhetetlen az ovulációhoz. A sejtmechanizmusok magukban foglalják a petefészek theca sejtjeit, ezáltal a sejtek termékei lehetővé teszik, hogy a granulosa sejtek ösztrogéneket termeljenek. Az ösztrogének negatív visszajelzést adnak az agyalapi mirigy LH szekréciójáról a középső follikuláris fázison keresztül. Végül az ösztrogén felhalmozódása olyan nagy, hogy LH-hullám következik be és ovulációt vált ki [4]. Egy ovulációs elhízott nőnél az LH és az FSH következetesen csökken, és az ovuláció után a petefészek csökkenti az ösztrogén és a progeszteron termelését. Ez a relatív hipogonadotrop hipogonadizmus potenciális etiológiát jelent az ovulációs elhízott nők általános termékenységének csökkenésére [5].
Aromatáz inhibitorokat (AI) alkalmaztak a hormon-egyensúlyhiányok feloldására PCOS nélküli nőknél. Az aromatáz egy mikroszómás citokróm P450 hemoprotein, amelyről ismert, hogy végrehajtja az androsztenedion ösztronná és tesztoszteront ösztradiollá történő átalakításának legfontosabb lépéseit. [6, 7] Számos különböző típusú szövetben található meg, beleértve az agy-, emlő-, placenta-, petefészek-, here-, endometrium-, bőr-, csont- és zsírszöveteket [7]. Az aromatáz enzim inhibitorairól kimutatták, hogy segítenek az LH szintjének és a pulzus amplitúdójának szabályozásában. [6, 8, 9] Bayar és munkatársai tanulmánya. kimutatta, hogy az AI beadása 81% -os ovulációs arányt adott az anovulációs résztvevőknél, és összesen 9% -os terhességi arányt. [10] Korábban kimutattuk, hogy az ösztrogén kezdeti negatív visszacsatolásának megszakításával az LH-ra a korai follikuláris fázisban az LH-szint megemelkedik a menstruációs ciklus alatt [9]. Az LH növelésével ebben a szakaszban az ember növeli annak esélyét, hogy a downstream hormonok szintje normális legyen. Lehetséges, hogy mivel az FSH ugyanazt a szekréciós mintát követi, mint az LH, és az agyalapi mirigyből is kiválasztódik, ezek a szintek is emelkedhetnek [7].
A jelen jelentés célja annak vizsgálata, hogy a letrozol, egy aromatáz inhibitor, képes-e normalizálni az elhízott és normál testsúlyú (NW) nők eltérő hormonprofiljait. A letrozol felezési ideje viszonylag rövid, reverzibilis inhibitor, és tabletták formájában is bevehető [7, 8]. Egy korábbi kísérleti jelentésben letrozolt adtunk be, 4 óra gyakori vérvétel mellett öt normál testsúlyú nőnek. A protokoll részeként a GnRH stimulációról korábban nem számoltak be [9]. Feltételezzük, hogy a letrozol adása ovuláló, elhízott nőknek az ösztrogén negatív visszacsatolás megszakításával elmozdítja a hipogonadotrop fenotípust az LH és az FSH megemelkedett szintjének elősegítésére.
Anyagok és metódusok
Ehhez a tanulmányhoz a 18–40 éves nők normális testtömeg-indexe 18–25 kg/m 2 (ÉNy; N = 10) és nők, akiknek a BMI-ja 30 kg/m 2 felett van (elhízott; N = 12) felvételt nyertek és letrozollal kezelték a korai follikuláris fázisban. Mindegyiket PCOS-ra szűrtük, az oligomenorrhoea jelenléte határozta meg, amint azt az NIH leírja. A résztvevők mindegyikének rendszeres menstruációs ciklusa volt a 25–35 napos tartományon belül. Egyéb felvételi kritériumok közé tartozott a beiratkozáskor a 18–40 éves életkor, a rendszeres menstruációs ciklus 25–35 napig, a reproduktív hormonokat zavaró krónikus betegség, a normális TSH és a prolaktin jelenléte, valamint a reproduktív hormonokat kölcsönhatásba lépő vagy megzavaró gyógyszerek használata. Kizárták azokat a nőket, akik túlzott testmozgásban (több mint 4 óra/hét) vettek részt.
A jegyzőkönyv
A 2–5. Ciklusnaptól kezdve a letrozolt összesen 7 napig adták a testfelület alapján. Ezért az elhízott nők közül hat kapott 5 mg-ot, míg a többiek 2,5 mg-ot. 7 napos kezelés után a résztvevők 10 óránként 6 órán át gyakori vérmintán vettek át egy GnRH-bólust (75 ng/kg), amelyet a vizsgálati látogatás vége előtt 4 órával adtak be. E vizsgálat egy résztvevője kivételével minden résztvevő napi vizeletmintákat gyűjtött e menstruációs ciklus során, amelyeket FSH, LH, PDG és E1c szintekre mértek [6].
Történelmi ellenőrzések
Valamennyi vizsgálatban DELFA immunfluorometrikus vizsgálatot (Perkin-Elmer) alkalmaztunk az LH és az FSH mérésére. Inter-assay és intra-assay CV-k: 4,8% és 5,4%, LH esetén 6,3% és 4,2%, FSH esetén. Napi vizeletmintákat vizsgáltunk E1c és Pdg szempontjából. A hormonkoncentrációkat a glicerinhez igazítottuk, és a kreatininre normalizáltuk [12]. Az E1c és Pdg szinteket ELISA-val mértük és 28 napos ciklusra normalizáltuk. A vizsgálaton belüli és az inter-assay CV-k 2,2% és 6,8% voltak az E1c esetében; illetve 2,3% és 4,5% a Pdg esetében.
Adatelemzés
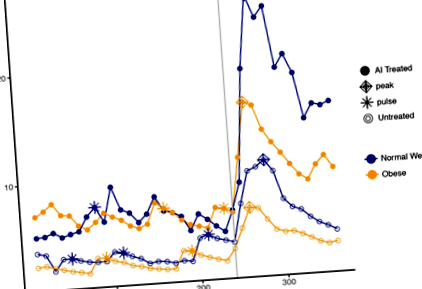
Az LH pulzilitást az egyes vizsgálati periódusok adatainak első 4 órája alapján jellemeztük. Az LH impulzus frekvenciáját és amplitúdóját egyedenként kiszámítottuk egy módosított Santen-Bardin impulzus detektálási módszerrel, amelyet korábban validáltunk [13]. A GnRH utáni beadást mind az LH, mind az FSH átlagos szérumszintet, csúcsszintet, a görbe alatti területet és a maximális választ kiszámítottuk; Ezeket a paramétereket bemutató reprezentatív LH hormonprofilokat a normál testsúlyú és elhízott betegektől a kontroll és az AI-vel kezelt karokban az 1. ábra szemlélteti. Ezeket az intézkedéseket csak a bolus idejét és az azt követő 2 órát használva számoltuk ki. egyenértékűség a két vizsgálat között. A csúcsszintet a GnRH bolus beadása utáni maximális hormonkoncentrációként határozták meg, a maximális választ pedig a GnRH előtti mélypont és a GnRH utáni csúcs közötti aritmetikai különbségként határozták meg, ahol a legalacsonyabb az átlagos hormonszint az órában a GnRH beadását megelőzően. Az eredményeket log (transzformált bázis) átalakítottuk, hogy kezeljük a potenciális ferdeséget.
Az AI-vel kezelt (szilárd pontok) és kezeletlen (nyitott pontok) és normál testsúlyú (kék) és elhízott (narancssárga) alanyok hormongörbéi. Bolus GnRH-t adtunk be 240 percnél, amit a függőleges szürke vonal jelzett. Az impulzusokat csillagok jelölik; a csúcsokat gyémántok képviselik
Lineáris regressziók értékelték, hogy a BMI befolyásolta-e az AI kezelés hatását az eredményekre. A lineáris kontrasztokat használtuk a BMI és a kezelési csoportok közötti páronkénti különbségek kiszámításához. A log transzformációval kapott eredményeket visszaadtuk a természetes méretarányukba, és geometriai átlagként mutattuk be őket, a csoportok közötti szeres (vagy százalékos) változással. Az eredményeket szignifikánsnak, 0,05-ös szignifikancia szintnek tekintettük.
Eredmények
Az AI-vel kezelt és kezeletlen elhízott nők átlagos életkora és BMI-je hasonló volt (o > 0,55; Asztal 1). Az AI-vel kezelt és kezeletlen NW nők átlagos életkora és BMI-je szintén hasonló volt (o > 0,69; Asztal 1). A kezelési csoporton belül az elhízott és az új-nyugati nők átlagos életkora hasonló volt (o > 0,30; Asztal 1).
Az LH és az FSH különbségei elhízott AI kezeléssel
Pre-GnRH stimuláció, az elhízott AI-val kezelt nőknél magasabb volt az LH átlagos szintje (4,73 NE/L, 95% CI 3,47, 6,45), mint az elhízott, nem AI-vel kezelt nőknél (2,65 NE/L, 95% CI 1,94, 3,61) ) (o = 0,011; 2. ábra; Asztal 1). Ezek a különbségek a GnRH stimuláció után is fennmaradtak (o = 0,018). Az elhízott AI-vel kezelt és kezeletlen nők hasonló LH impulzus frekvenciákat mutattak (2,33 impulzus/4 óra, 95% CI 1,61, 3,05 vs. 2,00 impulzus/4 óra, 95% CI 1,28, 2,72; o = 0,51). Az AI-val kezelt elhízott nők impulzusai azonban átlagosan nagyobbak voltak (2,56 NE/l, 95% CI 1,66, 3,97), mint az elhízott, nem AI-vel kezelt nőknél (1,01 NE/L, 95% CI 0,65, 1,56).
A GnRH utáni stimuláció során az AI-val kezelt elhízott nők átlagos LH csúcsa 13,40 IU/L volt (95% CI 9,09, 19,74), míg a nem AI-vel kezelteknél 7,11 IU/L (95% CI 4,83, 10,48). elhízott csoport (o = 0,025; 2. ábra). Az LH AUC szintén közel kétszerese volt az AI-val kezelt elhízott nőknek a nem kezelt elhízott nőkhöz képest (1146 NE/L, 95% CI 756, 1735 vs. 578 NE/L, 95% CI 382, 876, ill., o = 0,024).
A GnRH stimuláció utáni átlagos FSH kivételével az FSH paraméterei nem különböztek elhízott betegeknél AI kezeléssel (o > 0,10). Az átlagos FSH-szint a GnRH-stimuláció után magasabb volt AI-val kezelt elhízottaknál, mint a nem kezelt elhízott nőknél (6,49 NE/L, 95% CI 5,06, 8,32 vs. 4,59 NE/L, 95% CI 3,62, 5,83, o = 0,049).
LH és FSH különbségek normál súlyú AI kezeléssel
Nem voltak statisztikai különbségek az LH paraméterekben az NW AI-val kezelt és a nem AI-val kezelt nők között (o > 0.112) (1. táblázat; 2. ábra). Számos érdekes mintát figyeltek meg. Az AI-vel kezelt NW átlagos LH-szintje magasabb volt (6,9 NE/L, 95% CI 4,0, 9,6), mint a normál testsúlyú, nem AI-vel kezelt nőknél (4,76 NE/L, 95% CI 3,39, 6,69), bár statisztikai szignifikancia nem érte el (o = 0,11). Ez a mintázat összhangban volt a poszt-GH stimulációval (1. táblázat). GnRH stimulációval az átlagos átlagos LH csúcs 1,5-szer magasabb volt az AI-vel kezelt NW nőknél, mint a nem kezelt NW nőknél (20,50 NE/L, 95% CI 13,68, 30,74 vs. 13,45 NE/L, 95% CI 8,80, 20,57; o = 0,16). A GnRH előtti stimuláció, az átlagos LH impulzusméret szintén nem különbözött az AI-vel kezelt és a nem kezelt csoportok között NW-ban (2,42 NE/L, 95% CI 1,56, 3,75 vs. 2,05 NE/L, 95% CI 1,30, 3,25; o = 0,60).
Normális testsúlyú nőknél az FSH-paraméterekben nem volt statisztikai különbség az AI-vel kezelt és a kezeletlen csoportok között (o > 0,082).
A csoportok közötti különbségek összehasonlítása
A kezeletlen csoportokban a pre-GnRH, az LH szint és az amplitúdó az elhízott nőknél szignifikánsan alacsonyabb volt az NW-hoz képest (o = 0,014 és o = 0,029, ill. A poszt-GnRH, az LH átlag, a csúcs és az AUC szintén szignifikánsan alacsonyabb volt az elhízott nőknél (o = 0,033, o = 0,031, o = 0,038, ill.) Ezzel szemben az AI-vel kezelt csoportban nem volt különbség a normális testsúlyú és az elhízott nők között (o > 0,091); ez igaz volt az LH és az FSH paraméterekre is (1. táblázat). Az AI-val kezelt elhízott nőknél azonban a kiindulási és a GnRH-stimuláció után nagyon hasonló LH paraméterek voltak, mint a kezeletlen NW nőknél (2. ábra; 1. táblázat).
Vita
Ebben a vizsgálatban normális és elhízott nőknél vizsgáltuk az LH-t és az FSH-t, AI és letrozol beadásával és anélkül, valamint a GnRH stimuláció előtt és után. Az átlagos LH magasabb mind az elhízott, mind a normál testsúlyú nőknél, akiket letrozollal kezeltek, és a GnRH által végzett stimuláció után az összes csoportnál nőtt az átlagos LH. ÉNy-i nőknél azonban az AI teljes hatása statisztikailag nem volt szignifikáns semmilyen LH- vagy FSH-paraméter tekintetében. Elhízott nőknél az átlagos LH szint és a pulzus amplitúdója szignifikánsan magasabb volt az AI kezelésre adott válaszként. Hasonlóképpen, a GnRH-stimulált LH és FSH szintek szignifikánsan magasabbak voltak az AI-vel kezelt csoportban. Tehát úgy tűnik, hogy az elhízott nők szelektíven reagálnak az AI kezelésre, tekintettel a gonadotropin szintjére.
Az FSH az LH-hoz hasonló mintát követett (az értékek magasabbak voltak AI beadásával), de a százalékos különbség kisebb volt és statisztikailag nem szignifikáns. Bár statisztikailag nem szignifikáns, lehetséges, hogy az FSH változásai klinikailag jelentősek lehetnek. Biológiailag a letrozol blokkolja az ösztrogén bioszintézisét, ezáltal csökkentve az ösztrogén negatív visszacsatolását a hipotalamusz/hipofízis tengelyén. Más munka kimutatta, hogy ez lehetővé teszi az agyalapi mirigy által az FSH nagyobb szekrécióját, amely elősegíti a follikuláris növekedést és fejlődést [14]. Így továbbra is lehetséges, hogy még az FSH kis változásai is növelnék az elhízott nők termékenységi kimenetelét; erre azonban egy terhességi rátával és kimenetellel végzett longitudinális vizsgálat adna jobb választ.
Az elhízásról ismert, hogy megváltoztatja a gonadotropinokat [5], de azt tapasztaltuk, hogy a letrozolra adott válaszként az ovuláló elhízott nők kiindulási hormonprofilja és a GnRH-ra adott válaszuk megnő, helyreállítva azokat olyan szintre, amely összehasonlítható a kezeletlen ÉNy-i nőknél megfigyeltekkel. Valóban, GnRH stimulációval az AI-vel kezelt elhízott nők átlagos LH-értéke meghaladta a nem AI-vel kezelt normál testsúlyú nők átlagos LH-értékét (2. ábra; 1. táblázat). Tehát úgy tűnik, hogy az AI kezelés megmenti az elhízás hipogonadotrop fenotípusát.
Az elhízás megváltoztathatja az LH expresszióját az agyalapi mirigy szintjén, amint azt Kucherov és mtsai. [9] Vizsgálatunkban az LH impulzus amplitúdójának szignifikáns növekedését tapasztaltuk az elhízott kohorszban az AI beadása után (2. ábra; 1. táblázat). Eredményeink az agyalapi mirigyet is támogatják, mint az aromatáz gátlásának hatását, mivel a letrozol beadása után az amplitúdó, nem pedig a gyakoriság nő.
Ennek a vizsgálatnak az erősségei közé tartozik a normál testsúlyú és az elhízott kontrollcsoportok használata, a letrozol dózisának testfelülethez történő igazítása, és közvetlenül az agyalapi mirigyre figyelve, hogy azonosítsák azt az LH kontroll helyeként. A gyengeségek magukban foglalják a viszonylag kis mintaméretet és a megfigyelési periódust, valamint az idővel elkülönített kontroll és intervenciós csoportok alkalmazását, kizárva az egyes résztvevők páros összehasonlítását. Elismerjük, hogy a termékenységre gyakorolt lehetséges hatásokra következtetni lehet, mivel a tanulmány nem vizsgálta a terhesség kimenetelét.
Mivel az elhízás gyakorisága folyamatosan növekszik a fejlett és a fejlődő országokban, fontos lesz, hogy az orvosok oktassák pácienseiket arról, hogy a BMI hogyan befolyásolja termékenységüket és terhességi eredményeiket. A mérsékelt súlycsökkenés növeli az ovuláció és a szaporodás sikerét [15]. A jövőbeni tanulmányok egy olyan tervre összpontosíthatnak, amely magában foglalja az AI beadását a figyelt fogyás mellett a termékenységi terápiák kombinációjának hatásának megfigyelésére. Ez a tanulmány megmutatja a letrozol azon képességét, hogy növelje a spontán terhesség esélyét elhízott nőknél az LH-profiljuk normalizálásával.
Hivatkozások
Bazzano MV, Torelli C, Pustovrh MC, Paz DA, Elia EM. A cafeteria diéta által kiváltott elhízás megzavarja a patkányok termékenységét azáltal, hogy több petefészket érint. Reprodukálja a BioMed Online terméket. 2015; 31 (5): 655–67.
Polotsky AJ, Hailpern SM, Skurnick JH, Lo JC, Sternfeld B, Santoro N. A serdülőkori elhízás és az egész életen át tartó semmibe vétel szövetsége - a Women's Health Across the Nation (SWAN) tanulmánya. Fertil Steril. 2010; 93 (6): 2004–11.
Talmor A, Dunphy B. A nők elhízása és meddősége. Legjobb gyakorlat Res Clin Obstet Gynaecol. 2015; 29 (4): 498–506.
Choi J, Smitz J. Luteinizáló hormon és emberi koriongonadotropin: a különbség eredete. Mol Cell Endocrinol. 2014; 383 (1–2): 203–13.
Jain A, Polotsky AJ, Rochester D és mtsai. Az elhízott nőknél csökken a pulzáló luteinizáló hormon amplitúdója és a progeszteron metabolit kiválasztása. J Clin Endocrinol Metab. 2007; 92 (7): 2468–73.
Ross LA, Polotsky AJ, Kucherov A, Bradford AP, Lesh J, Chosich J és mtsai. A petefészek ösztrogénjének jelentős csökkentése elhízott nők aromatáz gátlásával. Elhízás (ezüst tavasz). 2014; 22 (6): 1464–9.
738 ACON, nőgyógyászok ACoOa. Aromatáz inhibitorok a nőgyógyászati gyakorlatban. Obstet Gynecol. 2018; 131: e194–9.
Klement AH, Casper RF. Az aromatáz inhibitorok alkalmazása az ovuláció indukciójában. Curr Opin Obstet Gynecol. 2015; 27 (3): 206–9.
Kucherov A, Polotsky AJ, Menke M, Isaac B, McAvey B, Buyuk E és mtsai. Az aromatáz-gátlás normális nőknél megnöveli a hipotalamusz-hipofízis kimenetének amplitúdóját, de nem gyakoriságát. Fertil Steril. 2011; 95 (6): 2063–6.
Bayar U, Basaran M, Kiran S, Coskun A, Gezer S. aromatáz inhibitor alkalmazása policisztás petefészek szindrómában szenvedő betegeknél: prospektív randomizált vizsgálat. Fertil Steril. 2006; 86 (5): 1447–51.
Al-Safi ZA, Liu H, Carlson NE és mtsai. Az ösztradiol-alapozás javítja a gonadotróp érzékenységet és a gyulladásgátló citokineket elhízott nőknél. J Clin Endocrinol Metab. 2015; 100 (11): 4372–81.
Santoro N, Crawford SL, Allsworth JE, Gold EB, Greendale GA, Korenman S és mtsai. A menstruációs ciklusok értékelése vizelet hormonvizsgálatokkal. Am J Physiol Endocrinol Metab. 2003; 284 (3): E521–30.
Santen RJ, Bardin CW. Epizodikus luteinizáló hormon szekréció az ember pulzusanalízisében, klinikai értelmezés, fiziológiai mechanizmusok. J Clin Invest. 1973; 52 (10): 2617–28.
Misso ML, Wong JL, Teede HJ és mtsai. Aromatáz inhibitorok a PCOS számára: szisztematikus áttekintés és metaanalízis. Hum Reprod frissítés. 2012; 18 (3): 301–12.
Nelson SM, Fleming RF. A prekonceptuális fogamzásgátló paradigma: elhízás és meddőség. Hum Reprod. 2007; 22 (4): 912–5.
- A hőhullámok és a hüvelyi szárazság értékelése elhízott, bariatrikus műtéten átesett nők körében
- Acanthosis Nigricans és metabolikus kockázati tényezők elhízott gyermekeknél SpringerLink
- Szorongás és depressziós hangulat elhízott terhes nőknél - leendő kontrollált kohort tanulmány - FullText
- Az NLRP3 gyulladásos blokád javítja az anyagcsere-egészséget és az élettartamot elhízott egereknél SpringerLink
- A tanulmány azt mutatja, hogy az agyi aktivitás, az ételjelekre adott válasz súlyosan elhízott nőknél eltér - írja a ScienceDaily