Az árbocsejtek megvédik az egereket a Mycoplasma Pneumonia ellen
Társított adatok
Absztrakt
Indoklás: A legkisebb szabadon élő baktériumként és a légúti fertőzések gyakori okaként a mikoplazmák egyedülálló kórokozók. A Mycoplasma pulmonis-szal fertőzött egereknél lokális, egész életen át tartó légúti fertőzés alakulhat ki, tartós gyulladással és átalakulással együtt.
Célkitűzés: Mivel a hízósejtek megvédik az egereket az akut szeptikus peritonitistől és a gram-negatív tüdőgyulladástól, feltételeztük, hogy védekeznek a mikoplazma fertőzés ellen. Ez a tanulmány teszteli ezt a hipotézist hízósejt-hiányos egerek felhasználásával.
Módszerek: A M. pulmonis légúti fertőzésére adott válaszokat vad típusú és hízósejt-hiányos Kit W-sh/Kit W-sh egerekben és ál-fertőzött kontroll egerekben hasonlítottuk össze.
Mérések és főbb eredmények: A végpontok magukban foglalják a mortalitást, a test és a nyirokcsomó súlyát, a mycoplasma antitest titerét, a tüdő mycoplasma terhelését és a fertőzés utáni időközönként a hisztopatológiát. Az eredmények azt mutatják, hogy a fertőzött Kit W-sh/Kit W-sh egerek más csoportokhoz képest nagyobb súlyt veszítenek és nagyobb valószínűséggel meghalnak. Az élő mikoplazma terhelés nagyobb a Kit W-sh/Kit W-sh-ben, mint a vad típusú egerekben a korai időpontokban. Négy nappal a fertőzés után a különbség 162-szeres. A mikoplazmaspecifikus IgM és IgA titerei korábban megjelennek és magasabbra emelkednek a Kit W-sh/Kit W-sh egerekben, de a hő által elpusztított mikoplazmára adott antitest válaszok nem különböznek a vad típusú egerektől. A fertőzött Kit W-sh/Kit W-sh egereknél nagyobb hörgő nyirokcsomók, progresszív tüdőgyulladás és légutak elzáródása alakul ki neutrofilekben gazdag exudátokkal, angiogenezissel és lymphangiogenesissel együtt. Vad típusú egerekben a tüdőgyulladás és az exudátumok kevésbé súlyosak, gyorsabban oldódnak meg, és nem járnak fokozott angiogenezissel.
Következtetések: Ezek a megállapítások arra utalnak, hogy a hízósejtek fontosak a légzőszervi mycoplasma fertőzés veleszületett immunrendszerében és gyógyulásában.
A mikoplazmák a legkisebb szabadon élő, önmagukat replikáló baktériumok, és szokatlanul kicsi a genomjuk (áttekintve a 14. hivatkozásban). Kulcsfontosságú szempontból különböznek a többi mikrobától, ideértve a sejtfal hiányát is. A mikoplazmák elsősorban nyálkahártya-kórokozók, extracelluláris parazitaként élnek, szoros kapcsolatban a gazda hámsejtjeivel, jellemzően légzőszervi és urogenitális traktusokban. A Mycoplasma pneumoniae a gyermekkori és felnőttkori tracheobronchitis és tüdőgyulladás vezető oka. A mikoplazmás betegségek fertőzése súlyosbíthatja vagy akár kiválthatja a nem fertőző légzőszervi betegségeket, például az asztmát és a krónikus obstruktív tüdőbetegséget emberben (15, 16) és rágcsáló modellekben (17, 18). Számos embert és más emlősöt megfertőző mikoplazma ismert arról a képességéről, hogy olyan krónikus betegségeket indukál, amelyekben a szervezet kitisztulása nehéz (14). Ez részben annak köszönhető, hogy a mikoplazmák elkerülhetik az immunfelismerést azáltal, hogy megváltoztatják a felszíni antigének repertoárját. Néhány mikoplazma elkerüli az immunfelügyeletet azáltal, hogy a gazdasejtekben él (19). Modulálhatják a gazdaszervezet immunválaszát és tartós fertőzést is létrehozhatnak. A Mycoplasma pulmonis természetes egér légúti megbetegedéseket okoz, hasonló megnyilvánulásokkal, mint a M. pneumoniae fertőzésben szenvedő embereknél (17, 20).
Feltételeztük, hogy mivel a tüdő hízósejtjei segítenek megvédeni néhány hagyományos baktérium akut fertőzését, védekeznek az akut és krónikus mycoplasma fertőzés ellen is. Ezen túlmenően, mivel a hízósejtek elősegítik az angiogenezis bizonyos típusait és stimulálják a légutak átalakulását krónikus allergiás gyulladásban (21–23), feltételeztük, hogy hozzájárulnak a mycoplazma által kiváltott átalakuláshoz (20, 24). Ezen hipotézisek teszteléséhez vad típusú és hízósejt-hiányos egerekben hasonlítottuk össze az M. pulmonisra adott légúti reakciókat. Ezen eredmények némelyikét absztrakt formájában közöltük (25).
MÓD
Mycoplasma fertőzés
Hízósejt-hiányos C57BL/6 készlet W-sh/Kit W-sh (Wsh) és vad típusú C57BL/6 Kit +/Kit + (+/+) egereket a leírás szerint (26) helyeztünk el, és 8-10 hetes kor, kivéve az örökbefogadó transzfer kísérleteket, amelyekben az egereket 17-18 hetes korukban fertőzték meg. Az egereket intranazálisan 5x105 cfu M. pulmonis CT7 törzzsel oltottuk be (27). Ezt az adagot kísérleti vizsgálatokkal állapították meg, amelyek nagy mortalitást mutattak ki nagyobb inokulációjú Wsh egerekben. A kiválasztott egerek kisebb inokulumot kaptak (105 cfu). A kontroll egerek steril húslevest kaptak.
Bruttó megfigyelések és hisztopatológia
A fertőzés után az egereket 28 napos időközönként leöltük. A végpontok között szerepelt a morbiditás, a test és a bronchiális nyirokcsomók súlya, valamint a tüdőgyulladás súlyossága, a hisztopatológiai pontozással értékelve (28).
Kvantitatív Mycoplasma kultúrák
A fertőzött tüdő homogenizátumait sorozatban hígítottuk agarlemezekre (17). A telepeket 7-10 nap múlva számláltuk.
Bronchoalveoláris lavage
Érzéstelenítés alatt steril, 22-es méretű katétert illesztettek a szabad légcsőbe. Bronchoalveoláris mosófolyadékot (BAL) gyűjtöttünk egérenként három, 0,8 ml-es foszfáttal pufferolt sóoldatból (PBS). A felülúszókat -80 ° C-on tároltuk.
Áramlási citometria
A fertőzés után 7 napig gyűjtött hörgő nyirokcsomókból szétbontott sejteket mostuk és fluoreszcein-izotiocianáttal konjugált anti-Mac-1 és CD69 (BD PharMingen, San Diego, Kalifornia), phikoeritrinnel konjugált anti-CD8 és Tri-Color konjugált sejtekkel inkubáltuk. anti-CD4 és B220 (Caltag, Burlingame, CA). A nem specifikus kötődést patkány anti-egér anti-CD16/32 gátlóval (BD PharMingen) blokkoltuk. A sejteket FACSCaliber áramlási citométerrel (Becton Dickinson, San Jose, CA) elemeztük.
Hőöléses mikoplazmával történő immunizálás
A 65 ° C-on 30 percig elpusztított M. pulmonis organizmusokat (0,5x106 vagy 20x106) intraperitoneálisan injektáltuk Wsh és +/+ egerekbe. A szérumot 28 nap múlva gyűjtötték be.
Antimycoplasma immunglobulinok mérése
Az M. pulmonis antigénnel bevont immunvizsgálati lemezeket (2x105 cfu/üreg 50 mM karbonátpufferben, pH 9,6) éjszakán át 4 ° C-on inkubáltuk. A lyukakat 2 órán át blokkoltuk 1% szarvasmarha szérum albuminnal (BSA)/PBS. Kezdetben 1:20 (IgG1 és IgG2a esetén), 1:10 (IgA és IgM) és 1: 5 vagy hígítatlan (IgE) hígított szérumot, majd PBS/0,05% Tween-20/0,5% BSA-val sorozatosan adtunk hozzá, majd 50 μl PharMingen biotinilezett anti-egér IgG1, IgG2a, IgA, IgM vagy IgE (1: 2000). Egy éjszakán át tartó inkubálás után 50 μl lúgos foszfatázzal konjugált sztreptavidint (1: 3000; Jackson ImmunoResearch, West Grove, PA) adtunk hozzá, és spektrofotometriásan detektáltuk 405 nm-en foszfatáz szubsztrát (Sigma, St. Louis, MO) alkalmazásával.
A hisztamin mérése
A hisztamin koncentrációt a tüdő homogenizátumaiban Immunotech ELISA-val (Beckman Coulter, Fullerton, Kalifornia) határoztuk meg a gyártó utasításai szerint.
Citokinek és felületaktív fehérjék mérése
A jeleket denzitometriával számszerűsítettük. A BAL citokin és kemokin szintjét ELISA készletekkel vizsgáltuk TNF-α, monocita kemoattraktáns 1 fehérje (MCP-1), valamint interleukin (IL) -6 (BD PharMingen) és makrofág gyulladásos fehérje 2 (MIP-2) (R&D Systems, Minneapolis, Minnesota); ezeket a fehérjéket azért választották, mert a hízósejtek választják ki őket, és részt vesznek a fertőzésre adott válaszokban. A felületaktív fehérje (SP) -A és az SP-D kollininek fokozzák a fagocitózist, szabályozzák a makrofág aktivitást (29) és kötődnek az M. pneumoniae-hoz (30). Összehasonlítottuk az SP-A-t és az SP-D-t Wsh és +/+ egerekben, sorozatosan hígított BAL felülúszók pontimmunblottozásával. Az anti-SP-A-t és az anti-SP-D-t blotokkal inkubáltuk (31) és torma-peroxidáz-konjugált anti-nyúl IgG-vel detektáltuk ECL-vel (Amersham Pharmacia, Piscataway, NJ). A jeleket denzitometriával számszerűsítettük.
Hízósejt-kultúra és örökbefogadó transzfer
Az 5-7 hét hét +++ egerek velősejtjeit több mint 95% hízósejtekké differenciálták 4-5 hét alatt (3). A Wsh egereket farok-vénába injektálták 107 sejttel, és 12 hét múlva tanulmányozták azokat az adatokat alapul véve, amelyek szerint az hízósejtek az injekció beadásától számított 12 héten belül benépesítik a Wsh tüdőt (26).
A hajó morfometriája
A fertőzés után kivágott egész szerelt légcsőket poliklonális anti-LYVE-1 és anti-egér CD31-vel inkubáltuk a nyirokerek és az erek jelölésére (27). A kontroll egerekből kivágott légcsöveknél az elsődleges antitestet kihagytuk, vagy a nemimmun szérumot helyettesítettük. A fluoreszcens képeken a LYVE-1– és a CD31-pozitív erek területi sűrűségét (a teljes szöveti terület százalékában) 10 1,7 mm 2 régió/légcső sztereológiai pontszámlálásával mértük.
Statisztikai analízis
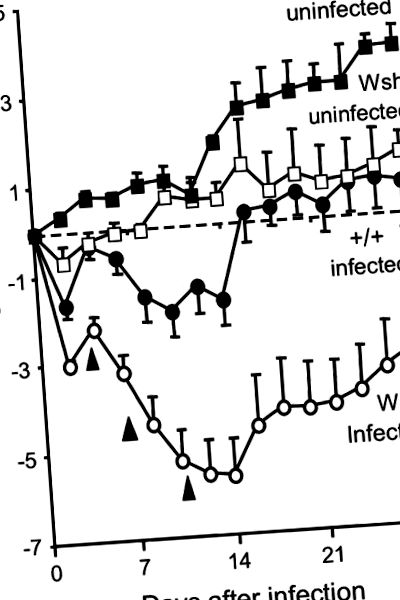
Az adatokat t teszttel vagy egyirányú varianciaanalízissel hasonlítottuk össze, p 1. ábra), de a Wsh egerek többet veszítenek, és hosszabb ideig tart a helyreállítás. 16 d-re az +/+ egerek megtérülnek a súlyukból, míg a Wsh 28 d-re nem tér vissza az alapszintre. Valójában a 22 fertőzött Wsh egérből 3 (de +/+ nincs) elhunyt. Rövid távú kísérletek során a helyreállítással helyreállított és megnövelt parenchimális és kis légúti hízósejt-populációkkal rendelkező Wsh egerek gyorsabban fogytak, és nagyobb valószínűséggel pusztultak el az első héten, amikor 0,5 × 10 6 cfu mikoplazmát kaptak (lásd E1. online kiegészítő). Az ötször kisebb inokulumot kapó hízósejt-rekonstruált egerek azonban lényegesen kevesebb súlyt vesztettek, mint a hasonló inokulumnak kitett nem helyreállított Wsh-egerek (p = 0,03; lásd E1 ábra).
Testtömeg változás és mortalitás mikoplazma fertőzés után Wsh és +/+ egerekben. Az első 2 hétben a fertőzött Wsh egerek fokozatosan nagyobb súlyt veszítenek, mint a fertőzött +/+ egerek. Három fertőzött Wsh egér nyílhegyekkel jelzett időpontokban halt meg. 2 hét múlva a túlélő fertőzött Wsh egerek hízni kezdenek. Az adatok átlag ± SEM; n = 5–21.
Hörghurut és tüdőgyulladás
A fertőzés utáni légúti és tüdőgyulladás súlyosságának vizsgálatához összehasonlítottuk a tüdő hisztopatológiai és a tüdőgyulladás pontszámát Wsh és +/+ egerekben. Mindkét típusú egérnél a fertőzés után 2 nappal neutrofil tüdőgyulladás alakul ki (2A – 2F. Ábra; lásd még az E2 ábrát). 4 d-re az akut gyulladás +/+ -on enyhül, Wsh-ben azonban nem. 7 d-kor a tüdőgyulladás előrehalad a Wsh egerekben, míg a leukocita infiltrátumok tovább csökkennek +/+ egereknél, a maradék gyulladás főként peribronchiolaris és perivascularis. A légúti váladékok kiemelkedőek a Wsh-ben, de nem +/+ egerek. 14 d-re a tüdőgyulladás és a váladékok progressziója a túlélő Wsh egerekben súlyos, míg a +/+ egerek lényegesen helyreálltak, a szétszórt infiltrátumok 28 d-nél fennmaradtak, míg a túlélő Wsh egerek súlyos szerveződő tüdőgyulladást mutatnak, a légutak gyulladásos váladékokkal fulladtak. A mennyiségi pontozás (2G ábra) megerősíti ezeket a benyomásokat. Így a hörghurut és a tüdőgyulladás hosszabb ideig tart és súlyosabb a Wsh-ben, mint az +/+ egereknél.
Tüdőgyulladás mycoplasma fertőzés után Wsh és +/+ egerekben. (A – F) A tüdő mikrográfiája 2, 14 és 28 napig gyűjtött M. pulmonis expozíció után (hematoxilinnal és eozinnal festve). (G) Wsh és +/+ egerek kvantitatív tüdőgyulladás-mutatói. A maximális lehetséges pontszám 26. Az adatok átlag ± SEM; n = 4–6; ** p 1. táblázat). A Wsh nyirokcsomók kétszer-négyszer nehezebbek, mint a fertőzés után 4–14 nappal a +/+ csomók. A 7 napig fertőzött egerek nyirokcsomósejtjeinek fluoreszcenciával aktivált sejtválogató analízise hasonló összes sejtszámot mutat a nem fertőzött Wsh és +/+ egerekben, míg a fertőzött Wsh összesített száma 2,7-szer nagyobb, mint a fertőzött +/+ egereknél, és csaknem ötszörös. magasabb, mint a nem fertőzött egereknél. A nem fertőzött Wsh és +/+ egerek hasonló hörgő nyirokcsomó populációkkal rendelkeznek a CD4 + és CD8 + T sejtek és a B220 + B sejtek között. Hét nappal a fertőzés után a T-sejtek százalékos aránya csökken és a B-sejtek emelkednek Wsh és +/+ egerekben egyaránt. A CD8 + sejtek aránya csökken a fertőzött egerek mindkét csoportjában, de kevésbé a Wsh egerekben. Így a fertőzött Wsh egerek nyirokcsomói meg vannak duzzadva limfocitákkal.
ASZTAL 1.
+/ + Nem fertőzött0 BRONCHIAL LYMPH CSOMÓ SÚLY ÉS SEJTPOPULÁCIÓK 7 nappal Mycoplasma pulmonis fertőzés után
- Hogyan működnek a zsírsejtek HowStuffWorks
- Hogyan lehet fogyni a zsírsejtek szerint; Dr
- Hogyan működnek a zsírsejtek és miért; s lehetetlen; éget; le őket - Kvarc
- A metionin-korlátozás súlycsökkenést okoz egerekben - Portsmouth Daily Times
- Hogyan állítja helyre Nadezhda Babkina az egészséget a tüdőgyulladás után - Newsy Today