A hosszan tartó, magas zsírtartalmú étrendi táplálás elősegíti az alkoholmentes zsírmájbetegséget és megváltoztatja az egerek bél mikrobiotáját
Kandy T Velázquez
Patológiai, Mikrobiológiai és Immunológiai Tanszék, Orvostudományi Kar, University of South Carolina, Columbia, SC 29209, Egyesült Államok
Reilly T Enos
Patológiai, Mikrobiológiai és Immunológiai Tanszék, Orvostudományi Kar, University of South Carolina, Columbia, SC 29209, Egyesült Államok
Jackie E Bader
Patológiai, Mikrobiológiai és Immunológiai Tanszék, Orvostudományi Kar, University of South Carolina, Columbia, SC 29209, Egyesült Államok
Alexander T Sougiannis
Patológiai, Mikrobiológiai és Immunológiai Tanszék, Orvostudományi Kar, University of South Carolina, Columbia, SC 29209, Egyesült Államok
Meredith S Carson
Patológiai, Mikrobiológiai és Immunológiai Tanszék, Orvostudományi Kar, University of South Carolina, Columbia, SC 29209, Egyesült Államok
Ioulia Chatzistamou
Patológiai, Mikrobiológiai és Immunológiai Tanszék, Orvostudományi Kar, University of South Carolina, Columbia, SC 29209, Egyesült Államok
James A Carson
Patológiai, Mikrobiológiai és Immunológiai Tanszék, Orvostudományi Kar, University of South Carolina, Columbia, SC 29209, Egyesült Államok
Egészségügyi Szakmai Főiskola, Tennessee Egyetem Egészségtudományi Központ, Memphis, TN 38163, Egyesült Államok
Prakash S Nagarkatti
Patológiai, Mikrobiológiai és Immunológiai Tanszék, Orvostudományi Kar, University of South Carolina, Columbia, SC 29209, Egyesült Államok
Mitzi Nagarkatti
Patológiai, Mikrobiológiai és Immunológiai Tanszék, Orvostudományi Kar, University of South Carolina, Columbia, SC 29209, Egyesült Államok
E Angela Murphy
Patológiai, Mikrobiológiai és Immunológiai Tanszék, Orvostudományi Kar, University of South Carolina, Columbia, SC 29209, Egyesült Államok, [email protected]
Támogatja az Országos Egészségügyi Intézet, NCI-3R01CA121249-08S1; NCCIH-K99AT009206 és NCI-1R21CA191966 sz. .
Levelező szerző: E Angela Murphy, PhD, egyetemi docens, Patológiai, Mikrobiológiai és Immunológiai Tanszék, Orvostudományi Kar, Dél-Karolinai Egyetem, 6439 Garners Ferry Rd, Columbia, SC 29209, Egyesült Államok. [email protected]
Telefon: + 1-803-2163414 Fax: + 1-803-2163414
Absztrakt
HÁTTÉR
Az alkoholmentes zsírmájbetegség (NAFLD) nagyrészt az elhízás világszerte tapasztalható növekedésének köszönhető. Míg az életmódmódosításokat és a farmakoterápiákat alkalmazták a NAFLD enyhítésére, a sikeres kezelési lehetőségek korlátozottak. Az NAFLD-ben a biztonságos és hatékony gyógyszerek hosszú távú alkalmazásának megtalálása egyik fő akadálya a betegség gyors megindulása és progressziója a rendelkezésre álló preklinikai modellekben. Ezért olyan preklinikai modellekre van szükségünk, amelyek (1) utánozzák a NAFLD emberi megnyilvánulását, és (2) hosszabb progresszióval rendelkeznek, hogy lehetővé tegyék a kiváló kezelések megtervezését.
Az elhúzódó magas zsírtartalmú étrend (HFD) táplálásának modelljének jellemzése a NAFLD hosszú távú progressziójának vizsgálatához.
MÓD
Ebben a tanulmányban elhúzódó HFD etetést alkalmaztunk a NAFLD jellemzőinek vizsgálatára C57BL/6 hím egerekben. Az egereket 80 hétig HFD-vel (60% zsír, 20% fehérje és 20% szénhidrát) etettük az elhízás elősegítése érdekében (Old-HFD csoport, n = 18). Alacsony zsírtartalmú étrendet (LFD) (14% zsír, 32% fehérje és 54% szénhidrát) ugyanolyan ideig adtak az életkornak megfelelő egereknek (Old-LFD csoport, n = 15). További egércsoportot tartottak fenn az LFD-n (Young-LFD, n = 20) rövidebb ideig (6 hét) az életkorfüggő és az életkorfüggetlen hatások megkülönböztetése érdekében. A szövettani és molekuláris értékeléshez májat, vastagbélt, zsírszövetet és ürüléket gyűjtöttünk.
EREDMÉNYEK
A HFD hosszan tartó táplálása elhízáshoz és inzulinrezisztenciához vezetett. A szövettani elemzés a HFD egerek májában steatosist, sejtkárosodást, portális és lobularis gyulladást és fibrózist mutatott ki. Ezenkívül az endoplazmatikus retikulum stressz markereinek molekuláris elemzése megállapította, hogy a HFD egerek májszövetében megnövekedett a foszforilezett Jnk és a CHOP. Végül értékeltük az Old-LFD és az Old-HFD bélmikrobiális összetételét. Megfigyeltük, hogy az elhúzódó HFD-etetés egerekben növelte a Firmicutes törzs relatív bőségét. Nemzetségi szinten az Adercreutzia, Coprococcus, Dorea és Ruminococcus bőségének jelentős növekedését, valamint a Turicibacter és Anaeroplasma relatív bőségének csökkenését figyeltük meg HFD egerekben.
KÖVETKEZTETÉS
Összességében ezek az adatok arra utalnak, hogy a krónikus HFD fogyasztás egerekben utánozhatja a NAFLD betegeknél megfigyelt patofiziológiai és néhány mikrobiális eseményt.
Alap tipp: Ez a munka azt írja le, hogy a krónikus, magas zsírtartalmú étrendet fogyasztó egerek miként utánozhatják az alkoholmentes zsírmáj betegség klinikai jellemzőit. Hisztopatológiai, metabolikus és molekuláris megközelítéseket alkalmaztunk annak megállapítására, hogy az egerek tartós, magas zsírtartalmú étrendes táplálása pre-klinikai modellként alkalmazható steatosis, steatohepatitis, fibrózis, glükózzavarok, endoplazmatikus retikulum stressz hosszú távú beavatkozásainak tanulmányozására és a bél mikrobiális dysbiosisát.
BEVEZETÉS
Az elhízás a NAFLD fejlődésének jól jellemzett kockázati tényezője. Bár köztudott, hogy az elhízás egészséges táplálkozási szokásokkal és fizikai aktivitással megelőzhető [4,5], a klinikai környezetben történő beavatkozások nagyrészt sikertelenek voltak, különösen hosszú távon [6,7]. Így a legújabb kutatások az elhízás által kiváltott NAFLD-vel kapcsolatos kóros folyamatokat vezető utak megértésére összpontosítottak, hogy a terápiás célpontok azonosíthatók legyenek. Az állatmodellek kritikus fontosságúak e küldetés szempontjából, és nagymértékben javították a NAFLD fejlesztésével kapcsolatos megértésünket. Noha a NAFLD több állatmodellje létezik, a magas zsírtartalmú étrend (HFD) beadása széles körben alkalmazott modell volt [8]. Ennek a megközelítésnek azonban korlátja, hogy az egereknek történő HFD beadása a jelek szerint nem indukál jelentős NAFLD progressziót (azaz májsejt pusztulást, gyulladást vagy fibrózist) annak ellenére, hogy reprodukálhatóan ösztönzi az elhízást, a metabolikus szindrómát és a máj steatosisát [8]. A jelenség lehetséges magyarázata az, hogy a HFD táplálásának időtartama nem elég hosszú ahhoz, hogy jelentős NASH-t termeljen, még akkor is, ha diétás kezelést hat hónapig alkalmaznak. Ezért a HFD beadásának hosszabb időtartamára lehet szükség az emberi állapotban megfigyelt patológia összegzéséhez.
A bélmikrobiom a közelmúltban jelent meg bűnösként olyan krónikus betegségek kialakulásában, mint az elhízás [9,10], a cukorbetegség [11,12], a májbetegség [13,14] és a rák [15]. A NAFLD esetében a portális véna helyzete lehetővé teszi a baktériumok és a mikrobiális eredetű termékek könnyű hozzáférését a bélből a májba történő áttelepüléshez [16]. Ennek a hipotézisnek az alátámasztásaként a NAFLD-vel rendelkező elhízott embereken végzett vizsgálatok egészséges emberekhez viszonyítva feltárták a bél dysbiosisát [17,18]. Raman és munkatársai [17] a Lactobacillus fajok és a Firmicutes családból származó különféle mikrobák dúsulásáról számoltak be elhízott emberekben, NAFLD-vel. Eközben Wong és munkatársai [18] azt figyelték meg, hogy a NASH-betegeknél alacsonyabb a széklet bősége a Firmicutes-nek. Bár az emberi bél mikrobiota és a májbetegségek közötti kapcsolatot vizsgáló tanulmányok továbbfejlesztették a kapcsolat megértését, a bél dysbiosisát utánzó preklinikai modellek a NAFLD-ben még mindig hiányoznak [19].
Megkíséreltük megvizsgálni a krónikus HFD táplálkozásának a NAFLD-re gyakorolt hatásait egerekben. C57BL/6 egereket alkalmaztunk, tekintettel a HFD által kiváltott elhízásra. 60% zsírból, 20% fehérjéből és 20% szénhidrátból álló étrendet alkalmaztunk, amelyet 80 hétig tápláltunk az egereknek - ez a protokoll célja a zsírtartalmú étrend egész életen át tartó fogyasztásának utánzása. Elemzésünk nagyrészt a máj patológiájára, a fibrózisra, a gyulladásra és az endoplazmatikus retikulum (ER) stresszére összpontosított. Megvizsgáltuk az anyagcsere eredményeit és jellemeztük a széklet mikrobiotáját is 16S rRNS szekvenálással. Adataink azt mutatják, hogy a krónikus HFD-fogyasztás jelentős NAFLD-t és bél-bakteriális dysbiosist eredményez. Konkrétan a steatosis, a gyulladás, a sejtkárosodás, a fibrózis és az ER stressz jelentős növekedéséről számolunk be, amely az Actinobacteria és a Firmicutes törzs növekedésével, valamint a Bacteriodetes és Tenericutes törzsének csökkenésével járt.
ANYAGOK ÉS METÓDUSOK
Állatok és étrend
Metabolikus mérések és vizsgálatok
Az eutanázia előtt egy nappal minden csoportonként tíz egeret éheztünk öt órán át (fényciklus). Tudatos állatoknál vért vettünk, a farok hegyét ollóval kivágtuk, és heparinizált (0,12 cm átmérőjű, 7,5 cm hosszú) kapilláris csövekkel 70 μl vért gyűjtöttünk a farokvénából a glükóz és az inzulin mérésére. . A vércukorszintet glükométerrel (Bayer Counter, New Jersey, Egyesült Államok) mértük, a plazma inzulint pedig a Mercodia (Uppsala, Svédország) egér ELISA vizsgálatával határoztuk meg. Az inzulinrezisztenciát a HOMA index alapján számítottuk ki, a következő egyenlet felhasználásával: IR = (inzulin uU/ml) (glükóz mmol/L)/22,5.
Festés
A májat, a vastagbelet és a zsírszöveteket 4% paraformaldehidben rögzítettük, paraffinba ágyazva, metszettük, majd hematoxilin-eozinnal (HE) festettük. Picro-sirius vörös foltos készletet (Cat ab150681, abcam, Cambridge, MA, Egyesült Államok) a gyártó utasításainak megfelelően használtunk a máj megfestésére a fibrózis szövettani értékeléséhez. Olajvörös O festéshez fagyasztott májszöveteket vágtunk (10 μm) kriosztát segítségével (Leica Biosystems, Nussloch, Németország), és a festést a korábban leírtak szerint hajtottuk végre [20].
Hisztopatológia
A NAFLD szövettani pontozási rendszerét a HE és a picro-sirius vörös festés alapján érték el a Young-LFD (n = 6), az Old-LFD (n = 10) és az Old-HFD (n = 12) egerek májában, mint korábban leírt [21]. Okleveles patológus (I.C.) vakon értékelte a májrészekben a steatosis (0-3), a portális és lobularis gyulladás (0-3), a sejtkárosodás (0-2) és a fibrózis (0-4) szövettani eredményeit. A NAFLD Activity Score-t (NAS) a steatosis, a lobularis gyulladás, a sejtkárosodás (0-8) súlyozatlan pontszámainak összeadásával számítottuk ki.
Western blottolás
Röviden, a májat egy proteáz inhibitor koktélt tartalmazó Mueller pufferben homogenizáltuk (Sigma Aldrich, St. Louis, MO, Egyesült Államok). Az összes fehérje koncentrációt Bradford módszerrel határoztuk meg. Ugyanolyan mennyiségű nyersfehérje-homogenizátumot (20 μg) frakcionáltunk kézzel öntött SDS-poliakrilamid-géleken és elektroforetikusan áthelyeztünk egy PVDF-membránra egy Royal Genie Blotter (IDEA Scientific, Minneapolis, MN, Egyesült Államok) alkalmazásával. A membránokat Ponceau S oldattal festettük az egyenlő fehérjetöltési és transzfer hatékonyság igazolása érdekében. Western-blotokat végeztünk a Cell Signaling (Danvers, MA, Egyesült Államok) primer antitestjeivel (foszforilezett-IRE1α, IRE1α, XBP1, foszforilezett-EIF2α, EIF2α, foszforilezett-Jnk, Jnk, CHOP, β-aktin, foszforilezett-NFκB, NFκB ), AbD Serotec Raleigh, NC (F4/80) és Novus Biologicals Littleton, CO (foszforilezett-IRE1α).
Kvantitatív valós idejű PCR
A máj- és a vastagbélszövetben a génexpressziót két példányban hajtottuk végre, miután RNS-t izoláltunk trizol-reagenssel. A következő Taqman gén expressziós vizsgálatokat alkalmaztuk az Applied Biosystems cégtől: monocita kemoattraktáns protein-1 (MCP-1), interleukin 10 (IL-10), interleukin 17-alfa (IL-17α), interleukin 6 (IL-6), villás box P3 (Foxp3), vagy a tumor nekrózis faktor alfa (TNF-a). Az összes primert 18s rRNS-re normalizáltuk.
Mikrobiom elemzés
Statisztikai analízis
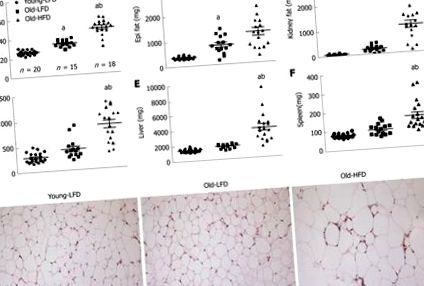
Hosszan tartó, magas zsírtartalmú étrend-etetésnek kitett egerek metabolikus jellemzése. V: Öt óra éhomi vércukorszint; B: Öt óra éhomi plazma inzulin; C: Az értékelés inzulinrezisztencia-indexének homeosztázis-modellje. Az adatokat átlag ± SE-ként fejezzük ki. n = 10 egér csoportonként. a Jelentősen különbözik a Young-LFD-től (P b Jelentősen különbözik az Old-LFD-től (P (3A ábra 3A - -C). C). A minták elemzése azt mutatta, hogy a Young-LFD egerek májának minimális fokális gyulladása volt, minimális perisinusoidális fibrózis, és nincsenek steatosis jelei (NAS pontszám 0-1) (ábra (3DD ábra - -J). J). Az öreg LFD egerek enyhe fokális gyulladást mutattak fokális steatosisral és perisinusoidalis fibrózissal (NAS score 1 -2). Old-HFD egerek esetében kiterjedt steatózist, portális és lobularis gyulladást figyeltünk meg sejtsérüléssel (a hepatociták ballonos degenerációja) és nyilvánvaló fibrózissal (NAS 5-6. Pont). a máj olajvörös O festéssel (ábra (3C ábra). 3C.) Összességében az olajvörös O festés bizonyítékot szolgáltatott a trigliceridek makrovesikuláris felhalmozódására az Old-HFD egerek hepatocitáiban, összehasonlítva a Young-LFD és az Old-LFD csoportokkal.
Hosszan tartó, magas zsírtartalmú étrendet végző egerek májszövetének szövettani értékelése. A: Hematoxilin és eozin; B: Pikroszpiros; C: A májszövet olajvörös O képei (200 X); D: A mikrovezikuláris steatosis szövettani pontszáma; E: Mikrovezikuláris steatosis; F: A májsejtek degenerációja balloo-olással; G: Acidophil testek; H: Lobuláris gyulladás; I: Fibrózis; J: Alkoholmentes steatohepatitis pontszám. Az adatokat interkvartilis tartomány mediánban fejezzük ki. n = 6-11 egér csoportonként. a Jelentősen különbözik a Young-LFD-től (P b Jelentősen eltér az Old-LFD-től (P (4A ábra 4A - -E). E). Az MCP-1 szignifikánsan magas volt Old-HFD és Old-LFD egerekben, összehasonlítva a Young-LFD-vel -LFD egerek (P a Jelentősen különbözik a Young-LFD-től (P b Jelentősen különbözik az Old-LFD-től (P (5A ábra). 5A). Mindkét idős csoport azonban szignifikánsan csökkent a foszforilált IRE1α-ban (ábra (5B ábra) ) 5B) és XBP1s (ábra (5C ábra) 5C), összehasonlítva a Young-LFD egerekkel (P (5D ábra) 5D) (P (5E ábra) 5E) (P (5F ábra) 5F) (P a a Young-LFD-től (P b Jelentősen eltér az Old-LFD-től (P (6C ábra 6C)) (P (6C ábra 6C és andE). E). Azonban nem találtunk változást az MCP-1, IL-10, vagy IL-17α (6AB ábra és DD) D) bármelyik csoport között A vastagbélszövet reprezentatív szövettani képei a 6F 6F ábrán hasonló vastagbélmorfológiát mutatnak a csoportok között.
Hosszan tartó, magas zsírtartalmú étrend-etetésnek kitett egerek gyulladásos jelzése a vastagbélszövetben. A vastagbélszövet reprezentatív szövettani képei (200 X) fiatal, alacsony zsírtartalmú étrendből (LFD), Old-LFD és Old-HFD egerekből. V: A monocita kemoattraktáns protein-1 (MCP-1) génexpressziója; B: Interleukin 10 (IL-10); C: Interleukin 6 (IL-6); D: Interleukin 17 (IL-17); E: P3 villafej (FoxP3). Az adatokat átlag ± SE-ként fejezzük ki. n = 10 egér csoportonként. a Jelentősen különbözik a Young-LFD-től (P b Jelentősen eltér az Old-LFD-től (P 7., 7. ábra, taxonómiai szinten hasonló fajgazdagságot figyeltünk meg (ábra (7A ábra). 7A). Azonban a fő koordináta (PC) elemzés Az OTU alapján az Old-LFD és az Old-HFD egerek között egyértelmű bélmikrobiota-összetétel mutatkozott (ábra (7B. ábra. 7B.). Mindkét csoportban a firicutes és a Bacteriodetes volt a legelterjedtebb phyla, amely 61% és 32% bél mikrobiotát tartalmazott Old-LFD egerek, illetve 73% és 21% Old-HFD egerekben (ábra (8A ábra 8A és andB). B). Következetesen a Firmicutes és Bacteriodetes arányát az Old-HFD egerekben megváltoztattuk, hogy a Firmicutes előnyére váljanak, amikor összehasonlítva az Old-LFD-vel (ábra (8C, 8C, P (9. ábra), 9), az Adercreutzia (Phylum-Actinobacteria), Coprococcus (Phylum-Firmicutes), Dorea (Phylum-Firmicutes) mennyiségének jelentős növekedését figyeltük meg ) és a Ruminococcus (Phylum-Firmicutes) old-HFD egerekben, összehasonlítva az Old-LFD egerekkel (P b Significa nagyon különbözik az Old-LFD-től (P b P ob/ob és C57BL6 egerek) [41]. Ennek ellenére nem minden C57BL/6 egérnél alakult ki NASH, amikor az egereket 30 hétig AMLN diétán tartották [39]. Így a HFD-fogyasztás meghosszabbítása - a jelenlegi tanulmányhoz hasonlóan - elegendő lehet a NAFLD homogénebb patológiájának elősegítéséhez.
Arra is törekedtünk, hogy megvizsgáljuk a vastagbél gyulladásos citokinjeit, amelyek szerepet játszanak a vastagbélgyulladás patológiájában a NAFLD és a gyulladásos bélbetegség (IBD) együttélése miatt [57-61]. Megfigyeltük az IL-6 és a FoxP3 növekedését az Old-HFD egerek vastagbélszövetében, de a csoportok között nem figyeltünk meg változásokat az MCP-1, IL-10 és IL-17α-ban. Az IL-6 növekedésének megállapításai összhangban vannak Jiang és mtsai [62] -vel, amelyek az IL-6 mRNS expressziójának növekedéséről számoltak be a NAFLD betegek bélnyálkahártyájában egészséges alanyokhoz képest. Mivel az IL-6-ot és a TNF-α-t is tartalmazó szisztémás gyulladás emberben mind a NAFLD-ben, mind az IBS-ben részt vett [57-61], nem vethetjük el, hogy a szisztémás gyulladás és/vagy a bélpermeabilitás fontos szerepet játszhat e rendellenességek kialakulásában. Vizsgálatunk során azonban nem mértük a szisztémás citokineket és a bélpermeabilitást. Tehát meg kell határozni, hogy a 80 hét múlva elhúzódó HFD-fogyasztás mutatja-e ezeket a jellemzőket, mint a jelenlegi tanulmány. A FoxP3 expressziójának növekedése valószínűleg a vastagbél krónikus alacsony fokú gyulladásának következménye, és részben megmagyarázhatja a vastagbél szövettani eltérésének hiányát.
Asztal 1
A bél mikrobiotával kapcsolatos változások alkoholmentes zsírmájbetegségben és alkoholmentes steatohepatitisben szenvedő betegeknél
- A táplálkozás szerepe az alkoholmentes zsírmájbetegség patogenezisében és megelőzésében Legutóbbi
- A gyermekkori zsírmáj és az elhízás nem mindig csak az alkoholmentes zsírmáj betegség kérdése
- A táplálkozás szerepe az alkoholmentes zsírmájbetegség patogenezisében és megelőzésében Legutóbbi
- Az alkoholmentes zsírmáj betegség diagnosztikájának új lehetőségei
- Alkoholmentes zsírmájbetegség (fekvőbeteg-ellátás) - amit tudnia kell