A rövid távú böjt hatása a rák kezelésére
Stefanie de Groot
1 Orvosi Onkológiai Osztály, Leideni Egyetem Orvosi Központ, Albinusdreef 2, P.O. Box 9600, 2300RC Leiden, Hollandia
Hanno Pijl
2 Leideni Egyetem Orvosi Központ Endokrinológiai Osztálya, P.O. Box 9600, 2300RC, Leiden, Hollandia
Jacobus J. M. van der Hoeven
1 Orvosi Onkológiai Osztály, Leideni Egyetem Orvosi Központ, Albinusdreef 2, P.O. Box 9600, 2300RC Leiden, Hollandia
Judith R. Kroep
1 Orvosi Onkológiai Osztály, Leideni Egyetem Orvosi Központ, Albinusdreef 2, P.O. Box 9600, 2300RC Leiden, Hollandia
Társított adatok
Absztrakt
A növekvő preklinikai bizonyítékok azt mutatják, hogy a rövid távú éhezés (STF) megvédi a toxicitást, miközben fokozza a különféle kemoterápiás szerek hatékonyságát a különféle daganattípusok kezelésében. Az STF megerősíti az egészséges sejtek stresszel szembeni ellenállását, míg a tumorsejtek még érzékenyebbek lesznek a toxinokra, talán tápanyaghiány révén, hogy kielégítsék szükségleteiket a magas proliferációs ráta és/vagy a szélsőséges körülményekre reagálás rugalmasságának elvesztése mellett. Emberekben az STF megvalósítható megközelítés lehet a kemoterápia hatékonyságának és tolerálhatóságának növelésére. Az STF potenciálját kiértékelő klinikai kutatások még gyerekcipőben járnak. Ez az áttekintés a molekuláris háttérre, a jelenlegi ismeretekre és az STF rákkezelésre gyakorolt hatásait értékelő klinikai vizsgálatokra összpontosít. Az előzetes adatok azt mutatják, hogy az STF biztonságos, de kihívást jelent kemoterápiában részesülő rákos betegeknél. A folyamatban lévő klinikai vizsgálatoknak meg kell bontakozniuk, ha az STF a napi gyakorlatban is csökkentheti a toxicitást és növelheti a kemoterápiás rendszerek hatékonyságát.
Háttér
A krónikus kalória-korlátozás csökkenti és késlelteti a rák előfordulását, és gátolja a tumor progresszióját és áttéteket a rágcsálókban [1–5]. Ennek megfelelően a rák előfordulása és mortalitása erőteljesen csökken a krónikus kalóriatartalmú nem főemlősökben [6]. Hosszan tartó kalóriatartalmú emberi alanyok vizsgálata kimutatta a rák kockázatával járó metabolikus és hormonális tényezők csökkenését [7–9]. A krónikus kalória-korlátozás azonban nem megvalósítható klinikai beavatkozás. A nyilvánvaló nehézségek, például az eredményességhez szükséges hosszú időszak és az elfogadhatatlan fogyás [10, 11], gátolják a klinikai alkalmazást rákos betegeknél.
A legtöbb rákterápiával ellentétben az STF-nek csak enyhe mellékhatásai vannak, például fejfájás, szédülés, émelygés, gyengeség és rövid távú fogyás az embereknél [26]. Ezért az STF ígéretes stratégia a kemoterápia hatékonyságának és tolerálhatóságának növelésére rákos betegeknél, különösen azért, mert az STF megfizethető és hozzáférhető megközelítés, és sokféle daganatban potenciálisan hatékony [12]. Azonban a súlyos fogyásban, szarkopéniában, cachexiában vagy alultápláltságban szenvedő betegek valószínűleg nem alkalmasak az STF-beavatkozásra [27, 28]. A legújabb irányelvek javasolják a fehérje- és zsírfogyasztás növelését cachexiás betegeknél [29, 30]. Így az STF különösen hasznos lehet (neo) adjuváns kemoterápiával kezelt, viszonylag fitt betegek esetében.
Ez a narratív áttekintés az STF-re adott válaszként az egészséges és rákos sejtek „differenciális stressz-rezisztenciáját” magyarázó molekuláris mechanizmusok jelenlegi ismereteire terjed ki. Ezenkívül összefoglalja a rendelkezésre álló klinikai adatokat, amelyek tükrözik az STF hatását a rákos betegek kemoterápiájának hatásaira. Végül kritikusan felülvizsgálják az STF rákkezelésre gyakorolt hatásainak folyamatban lévő klinikai tanulmányait.
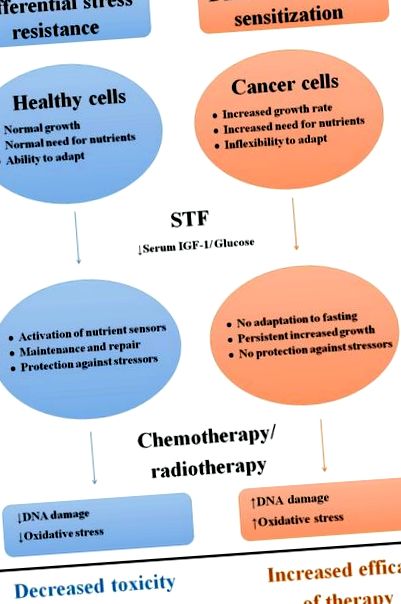
Differenciális stresszállóság és szenzibilizáció válaszként az STF-re
A rövid távú éhezés egészséges és rákos sejtekre gyakorolt különbségeinek sematikus áttekintése.
Rövidítések: STF; rövid távú éhezés, IGF-1: inzulin növekedési faktor-1.
Asztal 1
Az STF kemoterápia, sugárterápia és tirozin-kináz inhibitorok toxicitására és/vagy hatásosságára gyakorolt hatásának in vivo tanulmányainak áttekintése
A CT fokozott hatékonysága,
Az STF önmagában ugyanolyan hatékony volt, mint a CT önmagában, Megnövekedett túlélés
A CT fokozott hatékonysága
Az STF önmagában ugyanolyan hatékony volt, mint a CT önmagában
A CT fokozott hatékonysága önmagában az STF ugyanolyan hatékony volt, mint a CT önmagában
(csak szubkután modell)
24 óra STF (alternatív)
Csökkent toxicitás a CT-re
Nincs hatással a CT hatékonyságára
Csökkent toxicitás a CT-re
Nincs hatással a CT hatékonyságára
Biztonságos és kivitelezhető
A hányás csökkenése
Nem csökken az IGF-1
STF Rövid távú éhezés, CT kemoterápia, FMD koplalás utánzó étrend
Az IGF-1 és az inzulin a DSR kulcsszabályozói
Az IGF-1 és az inzulin az IGF-1 receptoron (IGF-1R) és az inzulinreceptor A izoformán (IR-A) keresztül jelezve a kalória és a fehérje rendelkezésre állására reagálva stimulálja a szaporodást és növekedést, valamint gátolja az apoptózist [50–53]. A szérum IGF-1 szintje csökken az STF során [54–56], mert az alacsony inzulinszint a máj növekedési hormon (GH) rezisztenciáját okozza, ami gátolja a máj IGF-1 termelését [54, 57, 58]. Az inzulin és az IGF-1 egyaránt aktiválja a Ras/mitogén-aktivált protein-kináz (MAPK) és a foszfatidil-inozitol-3-kináz (PI3K)/Akt útvonalakat. Egészséges sejtekben a proliferáció gátlása és/vagy a fenntartásba történő befektetés hozzájárulhat a fokozott stressz-ellenálláshoz. Például a máj Igf1 géndelécióval (LID) rendelkező egerek, amelyeknél az IGF-1 szintje hasonlóan csökkent, mint az STF során [59–61], fokozottan ellenállnak a különféle kemoterápiás szerek nagy dózisainak [42], és ez az előny semmissé vált az IGF-1 beadásával [12, 42]. Így az IGF-1R útvonal kulcsfontosságú közvetítője a stressz-rezisztenciának az egészséges sejtekben az STF-re adott válaszként.
Az STF során a Ras/MAPK és a PI3K/Akt útvonalakat a rákos sejtekben lefelé szabályozzák, ezáltal a proliferáció gátolt [64]. Nevezetesen az STF növekedést korlátozó hatásaival szembeni rezisztenciát figyeltek meg a PI3K út konstitutív aktiválódását okozó mutációkat hordozó rákos sejtekben, mivel ezek a sejtek inzulin vagy IGF-1 hiányában is szaporodnak [65]. Ezért az IGF-1R útvonal kulcsfontosságú közvetítője a rákos sejtek növekedésének és a rákrezisztenciának az általánosan alkalmazott terápiákkal szemben [42, 66, 67]. Így az IGF-1 és az inzulin keringő szintjének csökkenése az STF során hozzájárulhat a rákellenes aktivitáshoz is [68].
AMPK és autofágia
Az AMP-aktivált protein-kináz (AMPK) fontos szerepet játszhat a DSR-ben az STF miatt [69]. Az AMPK figyeli a sejtek energiaszintjét és aktiválódik, ha az ADP: ATP vagy az AMP: ATP arány megnő a sejtben [70]. Az AMPK gátolja az energiafogyasztó folyamatokat, például a sejtek szaporodását és a fehérjeszintézist, és aktiválja az energiatermelő folyamatokat, például a glikolízist és a zsírsav oxidációt. Gátolja a sejtek növekedését és stimulálja az autofágia kialakulását [71]. Az autofágia (görögül az „önevés”) az eukarióták körében erősen konzervált katabolikus folyamat a tápanyaghiányos időszakok túlélésére. A sejt ezen adaptív válasza károsodott fehérje és organelle lebomlással jár, amellyel alternatív energiaforrásként aminosavakat állíthatunk elő [72, 73]. Úgy tűnik, hogy az AMPK és az autofágia aktiválása fontos szerepet játszik az STF védőhatásaiban az egészséges sejtekben [17].
Az AMPK aktiválásának hatása a különféle daganatos sejtekben azonban eltérő lehet, mivel egyes daganatok konstitutívan aktív AMPK-t hordoznak [74, 75], mások pedig alacsony AMPK-aktivitást mutatnak [76–78]. A csökkent AMPK-aktivitású vagy autofágikus daganatok nagyon érzékenyek lehetnek az STF-re, mivel az AMPK-aktiváció fokozza az immunfelügyeletet [40], míg a nagyon aktív AMPK-val vagy autofágiával rendelkező tumorok rezisztensek lehetnek [77, 79–82].
A glükóz metabolizmusa és a „Warburg-effektus”
Az STF során az egészséges sejtek metabolikus rugalmassággal rendelkeznek a tápanyaghiány kezelésében, mivel a glükózt elsődleges energiaforrásként keton testek és zsírsavak helyettesíthetik.
Ezzel szemben a tumorsejtek a glükóztól függenek, hogy fenntartsák a sejtek proliferációjának nagy sebességét [83, 84]. Az Akt stimulálja az úgynevezett „Warburg-hatást”, amelyet az oxigén jelenléte helyett az oxidatív foszforiláció helyett a glikolízis fokozott üteme jellemez [83–85]. Az STF az anaerob glikolízist, míg a daganatsejtekben az oxidatív foszforilációt felfelé szabályozza, ez az „anti-Warburg-hatás” oxidatív stresszt és apoptózist eredményez [14]. Ezenkívül a fehérje transzlációjának ellenkező növekedése az STF során növeli a kielégítetlen energiaigényt, ami sejtpusztuláshoz vezet [12]. Sőt, a keringő glükóz 20–40% -os csökkenése az STF során elegendő lehet az anoxiás tumorsejtek elpusztításához [85]. Így a tápanyagok elérhetőségének csökkenése az STF során sebezhetőbbé teszi a rákos sejteket minden kihívással szemben, beleértve a kemoterápiát is. Az STF periódus utáni túlfogyasztás azonban felgyorsíthatja a tumor növekedését a magas glükóz állapotok és a fokozott glikolízis miatt [86].
Reaktív oxigénfajok és DNS károsodások
A kemoterápiás szerek oxidatív stresszt és DNS-károsodást okoznak az egészséges sejteken, amelyek a toxicitás alapjául szolgálnak [44, 87]. Az STF az anyagcsere sebességének csökkentésével és a reaktív oxigénfajták (ROS) fokozott eltávolításával csillapítja az oxidatív stresszt az egészséges sejtekben, ami hozzájárulhat a DSR-hez [33, 44]. Mivel a szérum glükózszint csökken az STF során, a zsírsavak szolgálnak fő energiaforrásként. A zsírsavak béta-oxidációja ketontesteket eredményez, amelyek alternatív/kiegészítő üzemanyagként használhatók. A keton testek aktiválhatják a ROS elleni védelemben részt vevő utakat is [88]. Sőt, az STF feltehetően aktiválja az egészséges sejtek DNS-helyreállítási folyamatait [22]. Például az egerekben 24 órán át éheztek az etopozid nagy dózisú infúziója előtt, 3 órával az infúzió után kevesebb DNS-károsodást tapasztaltak a vékonybél őssejtjeiben, mint azoknál az egereknél, akik ad libitumot ettek. Mivel a kezelés után 1,5 órával a DNS károsodása hasonló volt, az egészséges sejtekben a DNS helyreállítás valószínűleg hatékonyabb volt az STF miatt [21].
Ezzel szemben a tumorsejtek fokozott ROS-termelést mutatnak, ha a kemoterápiát in vitro STF-el kombinálják [12]. Alacsony glükóz táptalajban vagy éhomi egerek szérumában tenyésztett emlőrákos sejtekben a kemoterápiára reagálva a DNS károsodásának 20-szoros növekedése volt megfigyelhető, összehasonlítva a normál táptalajban vagy ad libitum táplált egerek szérumában tenyésztett sejtekkel [12].
Immun kompetencia
A kemoterápia a csontvelő toxicitását és a keringő immunsejtek kimerülését okozza, különösen a mieloid sejtek kimerülését [89, 90]. Az éhezés megvédi a vérképző őssejteket és a keringő immunsejteket az egerek kemoterápiájának káros hatásaival szemben [22, 91]. Ezenkívül az STF következtében a hatékonyabb immunitás feltehetően alacsonyabb fertőzési arányt és lázas neutropeniát is okoz [92].
Másrészt az éhezés javítja a kemoterápia terápiás hatását a daganatra, valószínűleg egerekben a sejtek immunitása révén, mivel ez a hatás semmissé válik a nu/nu egerekben, amelyekből hiányzik a T-sejt [40, 93]. Így az STF elősegítheti a tumorral társult antigének (TAA) immunitását és megjelenését, amelyek elősegítik a hatékony tumorellenes immunitást, hozzájárulva a kemoterápia fokozott hatékonyságához [94].
Az állatmodellektől a klinikáig
Az STF előnyeit dokumentáló preklinikai adatok bőségesek és ígéretesek. Az óvatosságra való szavak azonban megfelelőek a rákos betegeknél történő alkalmazásával kapcsolatban. Például a preklinikai vizsgálatok súlyos, bár átmeneti súlycsökkenést mutatnak állatmodellekben (a teljes test 20–40% -a 24–48 órás éhezés után [12, 19, 23, 39, 95]. Ezzel szemben a néhány napos koplalás az emberek testtömegénél sokkal szerényebbnek tűnik (
Napi 1 kg, nagyrészt vízveszteség) [26], ami valószínűleg az emberek és az egerek közötti metabolikus különbségekkel magyarázható [95]. Ez a biztonság szempontjából megnyugtató. Ez azonban azt is jelentheti, hogy az embereknek (sokkal) hosszabb ideig kell böjtölniük, mint az egereknek, hogy ugyanazokat az előnyöket megszerezzék (lásd az alábbi vitát). Ezért gondosan ellenőrzött klinikai vizsgálatokra van szükség, amelyek figyelemmel kísérik a daganatok növekedését, valamint a különféle táplálkozási rendszerek káros hatásait, mielőtt az éhgyomri utánzó étrendeket alkalmazhatnánk a klinikai gyakorlatban.
A rák metabolikus kockázati tényezői
Az elhízás több rák kialakulásának fokozott kockázatával jár együtt, például emlőrák, vastagbélrák, petefészekrák, endometrium rák és pajzsmirigyrák [96, 97], és az IGF-1 szint pozitív kapcsolatban áll az emlőrák és a prosztatarák kialakulásának kockázatával [98, 99]. Ezenkívül az elhízás, az inzulin és az IGF-1 magas szintje, valamint a diabetes mellitus a rosszabb túléléssel jár együtt a rákban [100–103]. Az elhízott alanyok gyakran hiperglikémiásak és hiperinzulinémiásak, az inzulinrezisztencia eredményeként. Bár a teljes (szabad + kötött) IGF-1 keringési szintje normális vagy akár alacsony is elhízott egyéneknél, a szabad (bioaktív) IGF-1 szintje magasabb, mint sovány alanyoknál [104]. Az inzulin és a szabad IGF-1 egyaránt megkötheti az IGF-1R-t és az IR-A-t [105], és aktiválhatja a Ras/MAPK és PI3K/AKT útvonalat, amelyen keresztül a sejtek proliferációját stimulálják, és az apoptózist gátolják, [106]. Sőt, preklinikailag az elhízás összefügg a makrofágok felhalmozódásával a zsírszövetben, amely immunszuppresszív mikrokörnyezetet eredményez [107]. Ezek az anyagcsere-mechanizmusok megmagyarázhatják a rák megnövekedett kockázatát, valamint több rák rosszabb prognózisát elhízott személyeknél.
Az éhezés klinikai vizsgálata
Metabolikus változások STF során emberekben
Az STF klinikai vizsgálata kemoterápia alatt
A mai napig publikáltak néhány kis klinikai vizsgálatot emberen, amelyek a kemoterápiával kombinált STF hatásait tárták fel (táblázat (2. táblázat) 2) [22, 131, 135–138]. Az embereken végzett vizsgálatok tervét és eredményeit az alábbiakban foglaljuk össze.
2. táblázat
Az STF kemoterápia toxicitására gyakorolt hatásának klinikai vizsgálata
Biztonságos és kivitelezhető.
A CT által kiváltott mellékhatások csökkenése.
Biztonságos és kivitelezhető.
A CT által kiváltott mellékhatások csökkenése a .
Biztonságos és kivitelezhető .
Csökkenti a leukociták DNS-károsodását (dózis-válasz).
Az IGF-1 csökkentése (dózis-válasz).
Biztonságos és kivitelezhető.
Az IGF-1 csökkenése
Jótékony hatással van az eritrocitákra és a trombocitákra
A DNS károsodásának lehetséges csökkenése egészséges sejtekben
Biztonságos és kivitelezhető
Jótékony hatással van a QOL-ra, a fáradtságra és a közérzetre
USC University of Southern California, KFMC King Fahad Medical City, LUMC Leiden University Medical Center, UC California California Davis University, Davis Veterinary Medicine School, STF rövid távú éhgyomor, szakaszos éhgyomor, CT kemoterápia, TAC docetaxel/doxorubicin/ciklofoszfamid, IGF-1 inzulinszerű növekedési faktor-1, QOL életminőség és statisztikák nem készültek
A King Fahad Medical City-ben klinikai vizsgálatot végeztek (> NCT00757094), hogy értékeljék a kemoterápia és az időszakos koplalás (beleértve a folyadékokat is) kombinációjának biztonságosságát és megvalósíthatóságát a ramadán idején [135]. Tizenegy beteg, különböző típusú rosszindulatú daganatokkal, egy ajándékban kapott kemoterápiát. A mellékhatásokat és a vérképeket összehasonlítottuk a kemoterápia hasonló dózisára adott válaszként mért értékekkel, 2 héttel a ramadán befejezése után. A szerzők arra a következtetésre jutottak, hogy a böjt és a kemoterápia kombinálása a ramadán hónapban jól tolerálható és biztonságos volt. A kemoterápia mellékhatásai általában kevésbé voltak. Mivel azonban a vizsgálati csoport kicsi volt, statisztikákat nem készítettünk. Ráadásul a rövid éhezési időszak (kb. 12 óra) miatt nem várható jelentős előny, mivel az IGF-1 szintje nyilvánvalóan nem fog csökkenni [140].
Végül Bauerfeld és mtsai. randomizált keresztezett vizsgálatot tett közzé (> NCT01954836), amelyben értékelték a kemoterápiával kezelt emlőrákos és petefészekrákos betegek STF életminőségére gyakorolt hatását [138]. A betegeket randomizálták gyors, FMD alkalmazásával, 36 órával a kemoterápia előtt és 24 órával, vagy normokalorikus mediterrán étrendet fogyasztani a kemoterápia első három ciklusában. Három ciklus után a beteg áttért a táplálkozás másik csoportjára (mediterrán étrend vagy koplalás). A tanulmány felépítése lehetővé teszi az egyénen belüli összehasonlításokat a kezelés mellékhatásaira vonatkozóan, de kizárja a következtetéseket mint a kemoterápia hatékonyságát. Összesen 50 beteget vontak be a vizsgálatba, de csak 34-et elemeztek a vizsgálat korai abbahagyása miatt. Az éhezés biztonságos és kivitelezhető volt, és öt beteg (14,7%) három ciklus után folytatta az éhezést, és nem lépett át a normokalorikus étrendre. A szerzők arra a következtetésre jutottak, hogy az STF jobb kemoterápiás toleranciát eredményezett, kevésbé romlott életminőséggel (QOL) és csökkentette a fáradtságot a kemoterápiát követő 8 napon belül. Sőt, 31 beteg kijelentette, hogy a kemoterápia során ismét koplalni fog, míg csak 3 beteg nyilatkozott úgy, hogy a kemoterápia alatt nem koplalna.
Ezeknek az első klinikai vizsgálatoknak nincs elegendő erejük határozott következtetések levonásához. Az első eredmények azonban arra utalnak, hogy az STF biztonságos, miközben csökkenti a kemoterápia toxicitását. Nagyszabású randomizált vizsgálatokra van szükség, hogy minél több betekintést nyerjünk az STF előnyeiből az emberek rákkezelésében.
Folyamatban lévő tanulmányok
Az első klinikai vizsgálatok kimutatták, hogy a kemoterápiával kombinált STF biztonságos és megvalósítható kis betegcsoportokban [131, 136, 138]. Ezenkívül az STF csökkentheti a kemoterápia által kiváltott toxicitást. Ezenkívül az egészséges sejtekben a kemoterápia által kiváltott DNS károsodás csökkenhet az STF miatt. Nagy (randomizált) klinikai vizsgálatokra van azonban szükség ahhoz, hogy (több) betekintést nyerjenek és validálják az STF lehetséges előnyeit a kemoterápia során. A 3., 3. táblázat áttekintést mutat az STF és a rák kezelésével kombinált folyamatban lévő vizsgálatokról.
3. táblázat
A kemoterápiával vagy sugárterápiával kombinált STF folyamatban lévő vagy publikálatlan klinikai vizsgálata
- Böjt és rák Előnyök és hatások
- A Sehydrin (Hydrazine Sulfate, HS) kezelésének tapasztalata előrehaladott daganatos betegeknél
- Nyaki diszplázia; Méhnyakrák természetes terápiák kezelés és megelőzés céljából
- Az étrend, a bélmikrobák befolyásolják a rák kezelésének eredményeit - ScienceDaily
- Kemoterápiás mellékhatások - OC vér; Rákellátás