A mikrobiota – gazda interakciók alakítják az öregedés dinamikáját
Max Planck Öregedési Biológiai Intézet, Köln, Németország
Dario Riccardo Valenzano
Max Planck Öregedési Biológiai Intézet, Köln, Németország
CECAD, Kölni Egyetem, Köln, Németország
Max Planck Öregedési Biológiai Intézet, Köln, Németország
Dario Riccardo Valenzano
Max Planck Öregedési Biológiai Intézet, Köln, Németország
CECAD, Kölni Egyetem, Köln, Németország
Absztrakt
Ez a cikk a „A mikrobiom szerepe a gazda evolúciójában” témakör része.
1. Bemutatkozás
2. A gazda – mikrobiota kölcsönhatásoknak hosszú evolúciós múltja van
1. ábra Gazdaspecifikus mikrobiota. A mikrobák és a többsejtű gazdaszervezetek együttes evolúciója kölcsönös kapcsolatokhoz vezet. A gazda dinamikus ökológiai fülkét épít, amely tápanyagokat és stabil környezetet biztosít a mikrobák számára. A mikrobiota viszont tápanyagokat és új anyagcsere-utakat biztosít. Az óramutató járásával megegyező irányban, jobbra fentről: a hüvelyesek gyökerei szimbiotikus kölcsönhatásokat hoznak létre Rhizobia a talajban lévő baktériumok, amelyek nitrogént kötnek a növény számára hozzáférhető molekuláris formákhoz. A hidra fajspecifikus mikrobiota modulálja a test spontán összehúzódásait és megakadályozza a halálos gombás fertőzéseket. A nedvet tápláló levéltetveknél endoszimbióta Buchnera biztosítja a gazdának a nedvben hiányzó esszenciális aminosavakat. A termeszekben található protiszták és flagellátok a lignocellulózt erjesztik fából. A ropogós tintahal a biolumineszcens szimbiotikus kolóniáknak ad otthont Aliivibrio fischeri könnyű szervében segít a védekezésben és a vadászatban. A kérődzőknél a cellulózfermentáló baktériumok rostban gazdag növényeket emésztenek gazdaszervezet számára hozzáférhető metabolitokká, például rövid láncú zsírsavakká (SCFA). Az emberi bélben lévő kommenzális mikrobák olyan tápanyagokat biztosítanak, mint az SCFA, a másodlagos epesavak és az esszenciális vitaminok. Ezt az ábrát B iorenderrel állítottuk elő .
A többsejtű gazda – mikrobiota kölcsönösség mindenütt előfordulását szélsőséges esetekben olyan kifinomult anatómiai rekeszek teszik lehetővé, mint például a speciális könnyű szervek a bobtail-tintahalban, a könnyű szervek a zseblámpa halakban és a kérődzők kérődzőkben. A mikrobiális partnerekkel való kommenzális kölcsönhatások kialakításához azonban az élőlények túlnyomó többsége speciális hámrétegekre, integritásokra és nyálkahártyákra támaszkodik, amelyek biztosítják a fizikai és belső elválasztást a belső és a külső rész között. Ezek a speciális membránok és rendkívül heterogén sejtösszetételük képesek védekezni, de biztosítják a felismerés és a molekuláris keresztetáplálás kulcsfontosságú funkcióit is a mikrobák és többsejtű gazdájuk között [10,11]. Az epithelia – microbiota molekuláris keresztbeszéd kifinomultsága eléri a komplexitás csúcsait a gerincesek vastagbélében, ahol a nyálkahártya immunitása megvédi a gazdaszervezetet a kórokozóktól, és elősegíti a kommensálok sokszínű közösségét (2. ábra). 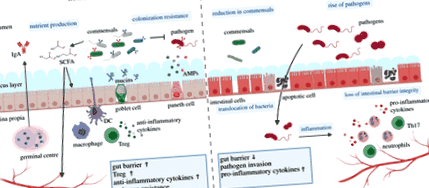
A rendkívül összetett mikrobaközösségek, mivel azonos fajok tagjai hasonlóak, meghatározzák a fajspecifikus mikrobiotát. Például az emberhez, a gorillához, a csimpánzhoz és a bonobókhoz vezető vonal fajspecifikus mikrobiális együtteseket mutat be, ahol a gazda specifikus anatómiai, fiziológiai és viselkedési adaptációi speciális mikrobiális kommensális közösségekhez kapcsolódnak, ami valószínűleg a gazdák és mikrobák közötti hosszú koevolúciós történelmet tükrözi. [12].
3. Adaptív immunrendszer és egy sokféle kommensális mikrobiota kialakulása
A veleszületett immunitás a kórokozókkal szembeni ősi védelmi vonal, amelyet a többsejtű szervezetek, köztük a növények és a gerinctelenek is megosztanak [37,38]. A veleszületett immunrendszer a szétválasztás, az antimikrobiális peptidek (AMP) szekréciója és a fagocitózis révén megakadályozza a fertőzéseket. A veleszületett immunitás azért alakult ki, hogy felismerje és automatikusan reagáljon egy előre meghatározott mikrobiális ligandumra, amelyre válaszként gyulladásos és vírusellenes válaszokat vált ki [39]. A speciális receptorok, köztük a Toll-szerű receptorok, a NOD-szerű receptorok és a C-típusú lektin-receptorok, amelyeket együttesen mint mintafelismerő receptorokat is ismerünk, azonosítják a konzervált molekuláris mintázatokat, és így kimutatják a kórokozókat vagy a sejtek hibás összetevőit [40–42]. Azáltal, hogy hatékony védekezési reakciókat nyújtanak a közös kórokozók ellen, pl. Az AMP révén a veleszületett immunitás formálja az egyszerű és a gazdaszervezet specifikus kommenzális mikrobiális közösségeket [43,44].
A T-limfociták segítenek fenntartani a gazda – mikroba egyensúlyt a nyálkahártya-szervekben a segítő sejtek speciális alosztályai (pl. Tregek) révén, amelyek gyulladáscsökkentő citokinek expressziójával és az effektor sejtekben gyulladáscsökkentő programok csillapításával reagálnak a kommenzális antigénekre [58]. . Ezenkívül a citotoxikus T-sejtek elősegíthetik a kommenzális mikrobákat azáltal, hogy szelektíven eliminálják a többi effektor sejtet [59].
A mikrobák specifikus mikrobiális köztitermékek (pl. Rövid láncú zsírsavak (SCFA)) szintézisével megvédhetik magukat a gyomor-bél traktusban az immunrohamoktól, amelyek lokálisan (pl. Vastagbélsejtekben és tágabban a bélhámban) csillapítják a gyulladásgátló reakciókat., valamint szisztémásan megváltoztatja a glükóz metabolizmusát és a T-sejt immunválaszait [60].
Azonban, ha egyrészt az adaptív immunitás lehetővé tette a gazdák számára, hogy komplex kommensális mikrobiális közösségeket irányítsanak, a gazdának nagy előnyökkel járva, másrészt új esélyeket teremtett a homeosztatikus kudarcra is, például amikor a jól kiegyensúlyozott gazda – mikrobiota interakció megnő. például autoimmun betegségek és öregedés során.
4. Öregedés és dysbiosis
Az öregedés szinte minden élő szervezet közös jellemzője, és gyakorlatilag minden homeosztatikus funkció életkorfüggő csökkenése jellemzi. Az öregedéstől függő diszfunkció skála a biológiai komplexitás minden szintjén, a DNS felhalmozódásától és a fehérje károsodásától a sejtekben, az organellum működési zavarokig (pl. Mitokondriális diszfunkció), a sejtek öregedéséig, a szervek diszbalanciájáig a megváltozott sejtösszetétel és irreverzibilis extracelluláris mátrix módosítások miatt [65] . Az életkorral összefüggő anyagcsere- és sejtváltozások a szisztémás és krónikus alacsony fokú gyulladások mellett fordulnak elő, amelyeket gyulladásnak neveznek [66]. A homeosztatikus egyensúlyhiány és az immunrendszer csökkenő funkciója korrelál a krónikus gyulladással, a fertőző betegségek arányának növekedésével, valamint a degeneratív betegségekkel, mint például az arteriosclerosis, a 2-es típusú cukorbetegség, a rák és az Alzheimer-kór [67]. Összesítve az öregedéstől függő szisztémás csökkenés a halálozás kockázatának fokozatos növekedéséhez vezet [68].
5. Immunrendszer – mikrobiota kölcsönhatások a gerincesek öregedése során
Az immunrendszer segíti a szisztémás homeosztázis és az egészséges szövetek fenntartását azáltal, hogy megszünteti a sérült, fertőzött és öregedő sejteket [85], és fenntartja az egyensúlyt a kommenzális és a patogén mikrobák között [86]. Az immunfunkció azonban az öregedés során súlyos változásoknak van kitéve, ideértve a sérült és fertőzött sejtek helytelen immunfelügyeletét, krónikus gyulladásos reakciókat és autoimmunitást, amely kiterjedt szövetkárosodáshoz vezet [87]. Ennek eredményeként az öregedés során a gazdaszervezet hajlamos a fertőzésekre és a betegségek széles spektrumára. A veleszületett és az adaptív immunfunkciók egyaránt változnak az öregedés során. Például egereken végzett munka kimutatta, hogy az intracelluláris vírusellenes mechanizmusok (például az interferon válaszok) az öregedés során aktiválódnak a LINE1 (L1) retrotranszpozonok visszaszorításának hatására. A sejtek a citoplazmatikus L1 DNS-t potenciális vírusfenyegetésként érzékelik, aktiválják a gyulladásos reakciókat és a sejtek öregedését indukálják [88], amely nagy szerepet játszik az öregedéssel kapcsolatos patológiában [89].
Az adaptív immunitás számos aspektusát az öregedés során is befolyásolja. A B-sejtek sokféleségének elvesztése [90] és az előállított antitestek alacsonyabb minősége, beleértve a nem specifikus antitestek feleslegét [91], az életkorral összefüggő immunműködési zavarokat eredményez, amelyek például hozzájárulhatnak fajunknál az idősek kevésbé hatékony oltásához [ 92]. Az emberi öregedés során a T-sejtek által közvetített immunitást befolyásolja a csecsemőmirigy inváziójával járó csökkent primer limfopoézis [93], valamint a T-sejt receptor repertoárjának csökkent sokfélesége [94,95]. A T-sejtek válaszainak funkcionális csökkenése az öregedés során összefüggésbe hozható az idősek magasabb rákkockázatával [96].
Az adaptív immunrendszer fejlődése hatalmas fitneszelőnyt jelentett a korai gerincesek számára, ami megkülönböztethette önmagát és nem önmagát, hatékonyan kiküszöbölve a kórokozókat és a parazitákat, és képessé téve a kommensák sokszínű közösségének létrehozására. Ha azonban az adaptív immunrendszer a gerinceseknek új lehetőséget kínál a komplex mikrobiota biokémiai sokféleségéhez való hozzáféréshez, ez egy új homeosztatikus kudarcmodalitás költségével is jár, amely javasoljuk a gerincesekre jellemző öregedési dinamika meghatározását.
A tiszta vízhez való hozzáférés, az oltások és az antibiotikumok miatt a fertőző betegségek már nem jelentik a legfőbb halálokot az iparosodott országokban. Azonban az idősek még mindig hajlamosabbak a fertőzésekre, mint a fiatal felnőttek [97]. Az autoimmun betegségekhez [98], a kórokozók által vezérelt immunhiányokhoz (pl. HIV-fertőzés miatt) [99] és az öregedéshez kapcsolódó immunhiány gyakran társul a bél dysbiosisával [100], amely a bélsor funkciójának életkorfüggő elvesztésével együtt, bakterémiához és szepszishez vezethet, vagyis az idős lakosság halálának két fő oka [97]. Az öregedés során az ön és a nem én közötti finom megkülönböztetés hibássá válhat, ami megnövekedett autoimmunitáshoz, a kórokozók potenciális toleranciájához vezethet [101], és megszüntetheti a gyulladáscsökkentő válaszok visszaszorítását a kommenszalokkal szemben. Az öregedés során bekövetkező immunhiányos zavarok az opportunista kórokozók szaporodásához és a kórokozókká váló kórokozókká válhatnak normál körülmények között a kórokozókká váló kórokozókká (81). A patobiontok pedig szintén okozhat okozhatnak autoimmunitást [102].
Itt azt javasoljuk, hogy a gerincesekre jellemző öregedési dinamika részben a mikrobiota és az adaptív immunitás bonyolult mechanisztikus kölcsönhatásától függ, amelynek hosszú evolúciós múltja van. Valójában az adaptív immunrendszer aktívan formálja a kommenzális mikrobiotát, amely viszont hozzájárul az immunrendszer fejlődéséhez és fenntartásához. A legújabb tudományos bizonyítékok azt mutatják, hogy a mikrobiota ok-okozati szerepet játszik az öregedés során. A mikrobiota fiatal-felnőttekből középkorúakba történő átültetése meghosszabbítja az élettartamot egy rövid életű gerinces modellrendszerben, ami azt mutatja, hogy a fiatalokkal társult bélmikrobák kumulatív módon pro-biotikus hatást fejtenek ki [71]. Hasonlóképpen, a mikrobiota fiatal egerekből középkorú egerekbe történő átültetése fokozta az immunműködést, újraaktiválva a bélben lévő hibás csíraközpontokat [103]; és a mikrobiota egészséges donorokból progeroid (azaz idő előtt elöregedő) egerekbe történő átültetése az élettartamhoz és az egészségmegnyújtáshoz vezetett.
Számos nyitott kérdés vár még megoldásra. Ha a mikrobiota ok-okozatosan befolyásolja az öregedési folyamatot, végezze el az egyénre jellemző öregedési dinamikát - pl. magasabb vagy alacsonyabb az öregedéssel összefüggő betegségek kockázata - függ az egyéni mikrobiota összetételtől? Elfogadhatjuk-e a mikrobiotát diagnosztikai eszközként az egyes betegségek kockázatának előrejelzéséhez? Ha minden fajnak megvan a maga, fajspecifikus mikrobiotája - amely élőhelyük, életmódjuk, evolúciós történetük és immunrendszerük sajátos funkciójának függvényében alakul ki -, akkor minden faj megfelel-e az öregedéssel kapcsolatos patológiákban? Ha a kommenzális mikrobák képesek elnyomni az immunválaszokat és támogatni az immun toleranciát (például SCFA-n keresztül), akkor a kórokozók eltéríthetik-e a kommensális molekuláris jelzését, hogy önző módon támogassák a patogenitást? Hogyan tudjuk fenntartani a gazda – mikrobiota egyensúlyt hosszabb ideig és az immunöregedés során?
A többsejtű gazdasejtek és mikrobiális partnereik evolúciója elképesztő biológiai újítások megjelenéséhez vezetett, ideértve a kifinomult adaptív immunrendszert is, ami újszerű anyagcsere-térhez való hozzáféréshez vezetett - amelyet a gazda számára kommensális mikrobái nyújtottak -, de a homeosztatikus kudarc új modalitásait is eredményezte, amelyek esetleg a gerincesekre jellemző öregedési dinamikát jellemzik.
Az adatok hozzáférhetősége
Ez a cikk nem tartalmaz további adatokat.
- A Royal Canin szervezi a macskák és kutyák elhízáskezelését vizsgáló internetes szemináriumot. Állatorvosi gyakorlat
- Kis intesztin mikrobiota A gazdaszervezet emésztési és abszorpciós adaptív válaszait az étrendre szabályozza
- Metoprolol és Theraflu Max-D súlyos hideg; Influenza-gyógyszer kölcsönhatások
- Metoprolol-szukcinát ER és alkohol-élelmiszer kölcsönhatások
- NRAS - Országos Rheumatoid Arthritis Társaság