A hidrogén-peroxid metabolizmusának terápiás lehetőségei az agyi ischaemia kezelésében
Armogida Márta
1 Kísérleti Neurológiai Laboratórium, Fondazione Santa Lucia IRCCS, Róma, Olaszország
Robert Nisticò
1 Kísérleti Neurológiai Laboratórium, Fondazione Santa Lucia IRCCS, Róma, Olaszország
2 Farmakobiológiai Tanszék, Calabria Egyetem, Rende (CS), Olaszország
Nicola Biagio Mercuri
1 Kísérleti Neurológiai Laboratórium, Fondazione Santa Lucia IRCCS, Róma, Olaszország
3 A Római Egyetem „Tor Vergata” Idegtudományi Tanszéke, Róma, Olaszország
Absztrakt
Elnevezéstan
Az ebben a felülvizsgálatban használt gyógyszer/molekuláris célnómenklatúra megfelel a British Journal of Pharmacology Receptorok és csatornák útmutatójának (Alexander és mtsai, 2011), ahol alkalmazható.
Történelmi jegyzetek
A H2O2 metabolizmusa
H2O2: paradox játékos
A H2O2 feltörekvő szerepe a sejtek működésének fiziológiai szabályozásában
A H2O2-ot gyakran élő rendszerek széles körében mérgező molekulának tekintik. Azt is beszámolták, hogy súlyos kóros állapotokban, például rákban, ischaemiában és neurodegeneratív betegségekben is szerepet játszik (Halliwell és Gutteridge, 1999; Halliwell és mtsai, 2000). A megalapozott bizonyítékok azonban a biológiai folyamatok fontos szabályozási jeleként betöltött szerepének újbóli értékeléséhez vezettek (Sundaresan és mtsai., 1995; Sen és Packer, 1996; Rhee, 2006; Stone és Yang, 2006; D ' Autréaux és Toledano, 2007; Miller és mtsai, 2007; Veal és mtsai, 2007; Gerich és mtsai, 2009; Groeger és mtsai, 2009; Rice, 2011), ami arra utal, hogy ennek az oxidánsnak a káros szerepe túlbecsülték. Különösen a H2O2 képes modulálni a szinaptikus transzmissziót (Pellmar, 1987; Katsuki és mtsai, 1997; Chen és mtsai, 2001; Avshalumov és mtsai, 2003; 2008) és a rágcsáló agy plaszticitását (Colton és mtsai, 1989; Auerbach és Segal, 1997; Klann és Thiels, 1999; Kamsler és Segal, 2003). A H2O2 szerepet játszik az intracelluláris Ca 2+ szignalizációban és az organella funkció modulációjában patkány hippocampusban is (Gerich et al., 2009). További bizonyítékok arra utalnak, hogy a H2O2 dinamikus modulációt hajt végre a nigrostriatalis dopaminerg (DAerg) rendszerben. Valójában az ATP-érzékeny K + csatornák (KATP) aktiválásával gátolja a substantia nigra DAerg idegsejteket és a striatalis DA felszabadulást (Chen et al., 2001; Avshalumov et al., 2003; 2005; 2008). Megjegyzendő, hogy a H2O2 izgató szerként is működhet a nem DAerg idegsejteken azáltal, hogy tranziens receptor-potenciál (TRP) csatorna (TRPM2 alcsoportú melasztatin típusú alvadás) aktiválását indukálja (Rice, 2011).
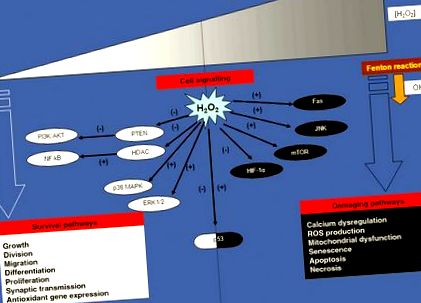
A H2O2 jelátvitel mechanizmusai, célpontjai és eredményei: koncentráció mint meghatározó tényező
A H2O2 paradoxon a sejtjelátviteli kaszkád szabályozásában. A H2O2 biológiai funkciói a sejtben lévő H2O2 koncentrációjától függenek. Alacsony koncentrációban a H2O2 hírvivőként működik a biológiai folyamatok sokféle változatában, hozzájárulva a sejtek túléléséhez. Nagy koncentrációban a H2O2 káros hatásokat okozhat, főleg OH-eredetű gyökök révén, súlyos oxidatív stressz és sejthalál kiváltásával. Ennek megfelelően a H2O2 kettős arcú cselekvés kulcsfontosságú célpontját a p53 tumor szuppresszor fehérje képviseli, amely vagy alacsony H2O2-szinttel aktiválható, antioxidáns választ kiváltva (anti-apoptotikus program), vagy gátolható magas H2O2-szint mellett programozott sejthalálra (pro-apoptotikus program).
H2O2 érzékelés iszkémiás károsodás során: következményei a neuroprotekcióra
A H2O2 hatása a rágcsálók in vitro és in vivo agyi ischaemia modelljeire
Feketeállomány
Terápiás-e az enzimatikus utak farmakológiai modulációja, amely a fokozott H2O2 O2 és H2O átalakuláshoz vezet?
A H2O2 termeléséhez vezető enzimatikus útvonalak modulálásának terápiás potenciálját, valamint annak O2 és H2O átalakulását (SOD, GPx, CAT) korábban transzgénikus vagy farmakológiai beavatkozási eszközökkel vizsgálták mind in vitro, mind in vivo ischaemiás modellekben. A H2O2 szignalizáció módosítása kulcsfontosságú lehet az idegsejt károsodásának expressziójában az IR epizódja alatt.
Célzó SOD enzim
A Cu, Zn-SOD enzimet túlzott mértékben expresszáló transzgénikus egerek jobban ellenállnak a fokális agyi iszkémiának (Yang et al., 1994). A Cu, Zn-SOD szelektív deléciója és túlzott expressziója azonban nem befolyásolja az állandó fokális agyi ischaemia kimenetelét (Chan et al., 1993; Fujimura et al., 2001). Éppen ellenkezőleg, az Mn-SOD szelektív deléciója rontja mind az átmeneti, mind az állandó MCAo eredményét (Murakami et al., 1998; Kim et al., 2002). Ezekből a vizsgálatokból kiderül, hogy szükség van egy ROS-produktív reperfúziós fázisra, hogy a SOD enzimek megváltoztassák az iszkémiás szövet sorsát (Warner et al., 2004). Tudomásunk szerint egyetlen publikált tanulmány sem értékelte még a SOD túlzott expressziójának hosszú távú hatásait az IR kimenetelére és az elért védelem stabilitására (Warner et al., 2004). Ismert, hogy a Cu, Zn-SOD extracellulárisan expresszáló egerek fokozott toleranciát mutatnak mind a fokális, mind a globális agyi ischaemia ellen (Sheng et al., 1999a; 2000), míg az extracelluláris Cu, Zn-SOD knockout egerek nagyobb károsodást mutatnak (Sheng et al. 1999b). A transzgénikus állatokon kapott adatokkal egyetértésben bebizonyosodott, hogy a polietilénglikollal konjugált SOD potenciálisan terápiás hatást fejt ki ischaemia esetén (Liu et al., 1989). Sőt, a nonpeptidil SOD-utánzó szerek hatékonynak bizonyultak éretlen patkányok hypoxia – ischaemia károsodásában (Shimizu et al., 2003). A rövid felezési idő, a vér-agy gáton való behatolás csökkent képessége és a SOD antigén jellege korlátozta farmakológiai alkalmazását.
Célzó GPx enzim
Emellett a GPx-t túlzott mértékben expresszáló egerek jobban ellenállnak az iszkémiás sértéseknek (Weisbrot-Lefkowitz és mtsai., 1998; Furling és mtsai., 2000; Ishibashi és mtsai., 2002). Megnövekedett infarktusméretet figyeltek meg a GPx knockout egereknél (Crack et al., 2001), valószínűleg a reperfúzió során az agyban tapasztalható túlzott H2O2 felhalmozódás miatt, míg az exogén GPx cerebroventrikuláris infúziója nem volt képes javítani a globális IR kimenetelét (Yano és mtsai, 1998). Másrészt a nem szelektív GPx utánzó ebselen számos ischaemia-modellben védő hatású (Warner et al., 2004).
Célzó CAT enzim
SOD és CAT enzimek egyidejű megcélzása
Konjugáció olyan makromolekulákkal, mint a liposzómába zárt SOD és CAT (Yusa és mtsai, 1984), polietilénglikol-származékok (Liu és mtsai, 1989; Armstead és mtsai, 1992; Yabe és mtsai, 1999) vagy szintetikus SOD – CAT mind a SOD, mind a CAT aktivitást mutató mimetikumokat (például salen – mangán komplexeket és mangán porfirint) végeztek (Baker et al., 1998; Doctrow et al., 2002; Zhou et al., 2007; Zhou and Baudry, 2009). az antioxidáns vegyületek agyszövetbe jutásának megkönnyítése, valamint az enzimatikus biohasznosulás és a felezési idő növelése. Vagy exogén SOD, vagy CAT transzdukció által közvetített sejtbe hatoló peptid PEP-1 fúziós fehérjék révén juttatva élő sejtekbe patkányokban megvédték a szívizomot az IR károsodástól. Továbbá a PEP-1-SOD1 és a PEP-1-CAT együttes transzdukciója fokozta védőhatásukat (Huang et al., 2011). Érdekes módon a megcélzott sejtbe hatoló CAT-származék fokozott peroxiszóma-célzási hatékonysággal (CAT-SKL) történő szállítással az újszülött patkány myocytáit is megvédte az IR-sérüléstől (Undyala et al., 2011). Ezenkívül az ischaemia előtti SOD/CAT utánzók adása neuroprotektívnek bizonyult az agyi ischaemia állatmodelljében (Sharma és Gupta, 2007).
A H2O2, mint előfeltételező tényező a neuroprotekcióban
Egy másik fontos szempont, amelyet figyelembe kell venni, a H2O2 hatása az iszkémiás prekondicionálási (IPC) jelenségre, amelynek során egy rövid, subletális ischaemiás epizód toleranciát vált ki a későbbi elhúzódó ischaemia ellen, amely általában halálos kárt okoz. Az IPC számos in vitro modelljében megfigyelték a kardioprotektív (Yaguchi et al., 2003) és a H2O2 neuroprotektív hatásait (Furuichi et al., 2005; Xiao-Qing et al., 2005). Valójában bebizonyosodott, hogy a H2O2 rövid OGD (10 perc) alatt történő képződése indukálja az IPC-t patkány primer tenyésztett kéreg neuronokban (Furuichi et al., 2005). Ezenkívül a H2O2 alacsony koncentrációban (10 µM) megvédheti a PC12 sejtvonalat a DA által kiváltott apoptózis ellen, valószínűleg a mitokondriális funkció helyreállításával (Xiao-Qing et al., 2005). Ennek megfelelően egy Simerabet et al. (2008) szerint a H2O2 (2 mM) sztereotaktikus in situ infúziója 24 órával az MCAo után (1 óra) csökkentette a patkány agyi infarktus méretét (kérgi terület), ami arra utal, hogy a H2O2 részt vesz az IPC indukciós szakaszában (Simerabet et al., 2008). Sőt, egy másik tanulmányban, amelyet Chang és mtsai. (2008), az exogén alacsony H2O2-koncentráció (15 µM) hozzájárulhat az OGD elleni IPC-hez (24 óra) patkány primer neuronokban azáltal, hogy növeli a HIF-1α fehérje expresszióját.
Következtetések és jövőbeli irányok
A H2O2 metabolizmus javasolt enzimatikus célpontjainak működési modellje az agyi ischaemia kezelésére. Az agyi ischaemia ellen terápiás hatást lehet elérni a H2O2-termelő (SOD) és a lebontó enzimek (CAT és GPx) farmakológiai modulációjával. In vitro és in vivo agyi ischaemia modellekben a neuroprotektálás CAT útvonal aktiválás révén valósul meg, főleg két mechanizmus révén: O2 kiegészítő termelése az O2 hiányának ellensúlyozására és a H2O2 eredetű • OH gyök társult-oxidatív stresszből történő méregtelenítés.
Ezenkívül kiemelkedő jelentőségű az ilyen kezelés terápiás potenciálja szempontjából a H2O2 káros hatásainak csökkenése normoxikus körülmények között (pl. Erős antioxidáns szerek alkalmazásával), valamint a H2O2 enzimatikus O2-degradációjának gyors fellendülése a CAT útvonalon keresztül (pl. hatékony SOD-CAT utánzók alkalmazásával). Meggyőződésünk, hogy a H2O2 anyagcserét célzó gyógyszerek terápiás potenciálját alaposan meg kell vizsgálni preklinikai szinten annak elméleti felhasználásának átalakítása érdekében, hogy az agyi ischaemia valódi klinikai alkalmazásban valósuljon meg. Jövőbeni kihívás az idegtudósok kezében a H2O2 jelátvitel által közvetített stroke kezelés validálása.
Köszönetnyilvánítás
Hálásak vagyunk Dr. Maria Lo Ponte-nak a kézirat nyelvi felülvizsgálatáért. Ezúton is szeretnénk köszönetet mondani a Vélemények Szerkesztőjének, Dr. Mike Curtis-nek, valamint a névtelen társszerkesztőnek és a lektoroknak észlelő és segítőkész észrevételeikért.
Szójegyzék
| 3-AT | 3-amino-1,2,4-triazol |
| ACSF | mesterséges agyi gerincfolyadék |
| BSO | butionin-szulfoximin |
| MACSKA | kataláz |
| DA | dopamin |
| DHE | dihidroetídium |
| fEPSP | a mező gerjesztő posztszinaptikus potenciálja |
| GPx | glutation-peroxidáz |
| HIF | hipoxia-indukálható faktor |
| IPC | iszkémiás előfeltételezés |
| IR | ischaemia-reperfúzió |
| KATP | ATP-érzékeny K + csatorna |
| MCAo | agyi artéria középső elzáródása |
| MCS | merkaptoszukcinát |
| mTOR | a rapamicin emlős célpontja |
| NF | nukleáris tényező |
| NOS | nitrogén-oxid szintáz |
| O2 | molekuláris oxigén |
| · O2 - | szuperoxid anion |
| OGD | oxigén/glükóz-nélkülözés |
| • OH | hidroxilcsoport |
| PGC1a | PPARγ koaktivátor1α |
| PI3K | foszfatidil-inozitol-3-kináz |
| PPARy | peroxiszóma proliferátor által aktivált receptor y |
| Prx | peroxiredoxin |
| ROS | reaktív oxigén fajok |
| SNc | substantia nigra pars compacta |
| GYEP | szuperoxid-dismutáz |
| TDP | tiolátfüggő foszfatáz |
| Tg (CAT) | transzgénikus egér expresszáló kataláz |
| TRP | tranziens receptor potenciál |
| WT | vad típus |
Összeférhetetlenség
A szerzők nem állítanak összeférhetetlenséget a cikk írása és/vagy publikációja tekintetében.
- Az urzolsav ígéretes terápiás potenciállal rendelkezik, de további bizonyítékok szükségesek Koreai felülvizsgálatra
- A moxibustion terápiás hatásai egyidejűleg az Nrf2-t és az NF-κB-t célozzák meg diabéteszes perifériában
- Tények a hidrogén-peroxidról itt: Mit kell tudni
- Víz levegő villamos hidrogén-peroxid Értékes vegyi anyag igény szerint a felhasználás helyén - ScienceDaily
- A fulvosav terápiás potenciálja krónikus gyulladásos betegségekben és cukorbetegségben