Peptikus fekélybetegség és Helicobacter pylori fertőzés
Absztrakt
A peptikus fekélybetegség (PUD) olyan általános állapot, amellyel mind az alapellátást nyújtók, mind a gasztroenterológusok találkoznak. A peptikus fekélybetegség tünetei változatosak lehetnek, beleértve a hasi fájdalmat, émelygést, hányást, súlycsökkenést és vérzést, vagy komplikált betegséggel járó perforációt. A PUD kialakulásához vezető kockázati tényezők és mechanizmusok azonosítása segít megérteni a diagnosztikai és kezelési stratégiák mögött álló megközelítést.
A peptikus fekélyekkel gyakran találkoznak az alapellátásban, és a kapcsolódó kockázati tényezők megértése kulcsfontosságú a betegségek megelőzésében és kezelésében.
Definíció és epidemiológia
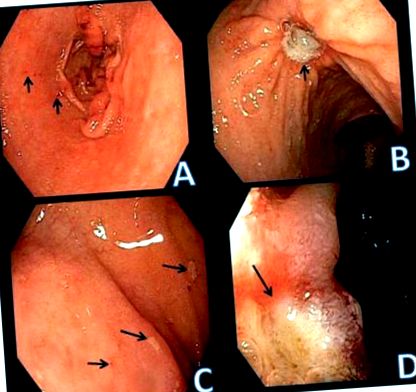
A peptikus fekélyek a gyomorban és a nyombélben található sav által kiváltott elváltozások, amelyekre a denuded nyálkahártya jellemző, és a hiba a submucosa vagy muscularis propria területére terjed ki.1 Az ilyen elváltozásokat, amelyek ezt a mélységet nem érik el, eróziónak nevezzük (1. ábra). Az Egyesült Államokban az orvos által diagnosztizált peptikus fekélybetegség előfordulási gyakorisága 10% volt 1990-ben, a hozzávetőleges előfordulási arány pedig évente körülbelül 500 000 új eset. 2, 3 Összességében azonban a halálozás kockázata és a a PUD miatti kórházi ápolás világszerte csökken. Ez valószínűleg másodlagos a Helicobacter pylori (H. pylori) fertőzések csökkenése miatt a kezelés és a jobb higiénia következtében. 4, 5 A vényköteles és vény nélkül kapható savcsökkentő gyógyszerek fokozottabb alkalmazása és a nagyobb óvatosság a nem szteroid anti- a gyulladásos gyógyszerek (NSAID-ok) részben ezt a tendenciát is figyelembe vehetik.5, 6
Peptikus eróziók és fekélyek a gyomorban és a nyombélben. A. apró eróziók a gyomor antrumában. A fokális vérzéssel járó nyálkahártya-töréseket a nyilak azonosítják. B. Jóindulatú gyomorfekély a gyomor testében (nyíl). C. A nyombél eróziói a tapadó váladék fókuszterületei alapján (nyilak). D. Nyombélfekély. A nyálkahártya hibájának mélysége van, és a margót a nyíl azonosítja. A környező nyálkahártya ödémás.
Etiológia és kórélettan
A PUD fő kockázati tényezői a H. pylori és az NSAID-ok használata, azonban nem minden H. pylori-val fertőzött vagy NSAID-t szedő egyénnél alakul ki PUD.1, 7 A világ népességének majdnem felét H. pylori telepíti. 8 A szervezet általában gyermekkorban szerezhető be, és a kezelésig fennmarad. A fertőzés megszerzésének kockázati tényezői közé tartozik az alacsonyabb társadalmi-gazdasági helyzet és az egészségtelen körülmények vagy a zsúfoltság. A H. pylori előfordulása magasabb a fejlődő országokban, és gyakoribb bizonyos etnikumoknál. Az elmúlt öt évben az Egyesült Államokban minden korban csökkent a H.pylori előfordulása. Mégis vannak különbségek etnikai hovatartozás alapján, a fertőzés aránya meghaladja a mexikói amerikaiak 60% -át, szemben a nem spanyol fehér lakosság 30% -ával.
A H. pylori gyulladásos választ okoz a neutrofilekkel, limfocitákkal, plazmasejtekkel és makrofágokkal a nyálkahártya rétegében, és hámsejtek degenerációját és sérülését okozza. A gyomorhurut általában súlyosabb az antrumban, a korpuszban alig vagy egyáltalán nincs gyulladás. Minden olyan beteget, amelynél peptikus fekélyek vannak, meg kell vizsgálni H. pylori szempontjából. Vannak invazív és nem invazív módszerek is a tesztelésre, amelyeket az 1. táblázat foglal össze. Az összes noninvazív módszer közül a karbamid-lehelet teszt és a széklet antigéntesztje a legmegvalósíthatóbb és pontosabb, mint a szerológiai vizsgálat.10 Bár invazív, az endoszkópia lehetővé teszi a biopsziát, és számos vizsgálati módszert tartalmaz, például szövettani, tenyésztési vagy gyors vizsgálati módszereket. ureáz teszt. A szerológián kívüli összes módszert befolyásolja a savt elnyomó gyógyszerek, például a protonpumpa-gátlók alkalmazása, és hamis negatívumokat okozhatnak.
Asztal 1
H. pylori diagnosztikai tesztjei
| Szerológia | 85–92% | 79–83% | Csak a tesztet nem befolyásolja a PPI vagy az antibiotikum használata | Nem lehet megerősíteni a gyógyulást |
| Karbamid légzési teszt | 95% | 96% | Megerősíti a gyógyulást | A PPI és az antibiotikum-használat által befolyásolt pontosság |
| Széklet antigén vizsgálata | 95% | 94% | Megerősíti a gyógyulást | A PPI és az antibiotikum-használat által befolyásolt pontosság |
| Gyors ureáz teszt | 98% | 99% | Olcsó, megerősíti a gyógyulást | Endoszkópiát igényel, kevésbé pontos a kezelés után vagy a PPI használata után |
| Szövettan | > 95% | > 95% | Megengedi a vizualizációt, megerősíti a gyógyulást | Endoszkópiát igényel, befolyásolja a PPI és az antibiotikumok használata |
| Kultúra | 70–90% | 100% | Lehetővé teszi az antimikrobiális érzékenység meghatározását, megerősíti a gyógyulást | Endoszkópiát igényel, az eredmény több napot vesz igénybe, befolyásolja a PPI és az antibiotikumok használata |
PPI, protonpumpa inhibitor
A nem szteroid gyulladáscsökkentőket széles körben alkalmazzák különféle betegségek esetén a fájdalom és a gyulladás csökkentése érdekében; azonban sok felhasználónak gyomor-bélrendszeri mellékhatásai vannak. Az NSAID-ok az összes fekély több mint 90% -át teszik ki, és az NSAID-felhasználók kb. 25% -ánál alakul ki peptikus fekélybetegség. 11 Az aszpirin-használóknak kétszer nagyobb az esélye a peptikus fekély kialakulására, mint az általános populációnak., amelyet nyálkahártya-vérzésnek és eróziónak tekintenek, és NSAID-gasztropátiának nevezik. Ezek a többszörös kis eróziók általában az antrumban helyezkednek el, de a testben is láthatók.
Az NSAID-ok több mechanizmus révén nyálkahártya-sérülést okoznak. Az NSAID-k többsége gyenge sav, és protonálódik, és keresztezi a lipidmembránokat, hogy savas gyomornedv (pH 2) hatására bejuthasson a hámsejtekbe. A hámsejtben (pH 7,4) az NSAID ionizálódik és felszabadítja H + -ját, és nem tud átjutni a lipidmembránon, és így csapdába esik. Ez az oxidatív foszforiláció szétválasztásához vezet, ami a mitokondriális energiatermelés csökkenéséhez, a sejtek integritásának csökkenéséhez és a sejtek permeabilitásának növekedéséhez vezet. Ez helyi sérülést és gyors hámsejt-pusztulást, felszíni vérzést és eróziókat eredményezhet.
A másik fő mechanizmus, amellyel az NSAID-ok nyálkahártya-sérülést okoznak, a prosztaglandin-szintézisért felelős ciklooxigenáz-1 (COX-1) gátlása. A prosztaglandinok fokozzák a bikarbonát és a nyálkahártya szekrécióját, fokozzák a nyálkahártya véráramlását és gátolják a sejtek szaporodását a nyálkahártya gátjának fenntartása érdekében.5 Az aszpirin-acetilátok ciklooxigenázt adnak és visszafordíthatatlanul gátolják az enzimet, míg az NSAID-k koncentrációtól függően reverzibilisen gátolják az enzimet. E patofiziológiai válaszok közül a véráramlás csökkenését gondolják úgy, mint az NSAID-ok által okozott sérülés elsődleges mechanizmusát.
A COX két izoformája létezik: A COX-1 elsősorban a prosztaglandin szintézisért felelős a GI traktusban, míg a COX-2 felelős a prosztaglandin szintézisért a gyulladás helyén. Az olyan NSAID-k, mint az ibuprofen, a naproxen, az aszpirin és az indometacin, mind a COX-1-et, mind a COX-2-t gátolják, és nem szelektívként vannak besorolva. A COX-2 specifikus NSAID-ok, például a celocoxib vagy a rofekoxib, a COX-1 gátlása nélkül gátolják a COX-2-t, így potenciálisan biztonságosabbá válnak a GI traktusban. A COX-2 inhibitorokat szedő betegek endoszkópos vizsgálata alacsonyabb, körülbelül 3-5% -os fekély előfordulási gyakoriságot mutatott, összehasonlítva a hagyományos NSAID-okkal, amelyek előfordulási gyakorisága 20-40%. A COX-2 szelektív NSAID-ok azonban kimutatták, hogy növelik a szívbetegség kockázatát, és sokukat kivonták a piacról.
Azok, akiknek a legnagyobb a kockázata az NSAID által kiváltott fekélyek szempontjából, azok a betegek, akiknek kórtörténetében peptikus fekély vagy vérzés van, akik egyidejűleg szteroidokat vagy antikoagulánsokat használnak, bárki, aki 65 évesnél idősebb, és akik nagy dózisban vagy egynél több NSAID kombinációját szedik (beleértve az alacsony adag aszpirin). Ha ezeknek a betegeknek több szerre van szükségük, a fekélyek megelőzése érdekében kezelést kell kezdeni. Ezenkívül olyan gyógyszerek használata, mint a szelektív szerotonin-újrafelvétel-gátlók, kortikoszteroidok, aldoszteron-antagonisták vagy antikoagulánsok, növeli a vérzés kockázatát. 15 Idősebb kor és nagyobb számú társbetegség is befolyásolja a H. pylori és NSAID-okkal rendelkező betegek klinikai lefolyását. 17 A H. pylori és az NSAID-k közötti kölcsönhatás ellentmondásos, de az Amerikai Gasztroenterológiai Főiskola jelenlegi irányelvei azt javasolják, hogy teszteljék és kezeljék a H. pylori-t, ha az egyén hosszú távú NSAID-okat akar kezdeni, és mérlegelni lehetne azokat is, akik hosszú távon alacsony dózisú aszpirint szednek. .5, 18
A PUD-esetek körülbelül ötöde nem kapcsolódik a H. pylori-hoz, az NSAID-okhoz vagy az aszpirinhez, de ennek az értéknek a pontosságát megkérdőjelezték hamis negatív H. pylori-teszt vagy véletlenszerű (vagy nem jelentett) NSAID-bevitel miatt. 19,20 Ez az idiopátiás PUD oka lehet a nyálkahártya integritását elősegítő tényezők és az agresszív sértések közötti egyensúlyhiány, beleértve a hiperszekréciós státuszt is. A PUD egyéb etiológiája a stressz fekélyeket okozó ischaemia, gyógyszerek (szteroidok, alendronát, kálium-klorid és kemoterápiás szerek), vírusfertőzések (CMV, HSV), gyomor bypass műtétek, anyagcserezavarok, sugárterápia, hisztamin, eozinofil infiltráció és bazofília., 21
Diagnózis
A diagnózis klinikai gyanúval kezdődik, amikor a betegek olyan tünetekkel jelentkeznek, mint az epigasztrikus hasi fájdalom, az égés, az étkezés utáni teltség vagy a korai jóllakottság.1 Klasszikusan a nyombélfekélyben szenvedő betegek panaszkodnak az üres gyomor súlyosbodó hasi fájdalmáról, és két éhséget vagy hasi fájdalmat írnak le. három órával étkezés után vagy éjszaka. Ezzel szemben a gyomorfekélyben szenvedő betegek hányingerről, hányásról, fogyásról és étkezés utáni hasi fájdalomról számolnak be. Az idős betegek gyakran minimálisan tüneti tünetekkel járnak, és néhány kezeletlen PUD-ban szenvedő betegnek időszakos tünetei lehetnek a spontán gyógyulás miatt, majd visszaeshetnek a kockázati tényezők, például az NSAID-ok folyamatos használata vagy a H. pylori-fertőzés következtében.
Ha a klinikai tünetek lehetséges peptikus fekélybetegségre utalnak, és riasztási tüneteket nem észlelnek, meg lehet kezdeni az empirikus kezelést antiszekréciós terápiával. Továbbá, mivel a H. pylori a PUD gyakori oka, a H. pylori nem invazív tesztjével (széklet antigén vagy karbamid légzési teszt) végzett teszt és kezelési stratégia ajánlott 55 évesnél fiatalabb betegek számára, riasztási jellemzők nélkül, földrajzi régiókban a gyomorrák nem gyakori, és a H. pylori előfordulása meghaladja a 20% -ot. 22 Idősebb és riasztási tünetekkel küzdő betegeknél endoszkópia ajánlott a diagnózis felállításához. A riasztási tünetek közé tartozik a GI vérzése, a súlycsökkenés, a korai jóllakottság, a dysphagia vagy az odynophagia, a családi kórelőzményben a felső GI rosszindulatú daganata, a vashiányos vérszegénység vagy az új felső GI tünetek 55,23 évnél idősebb betegeknél. PUD. Használható a H. pylori kimutatására gyomorbiopsziával, és kizárhatja a rosszindulatú daganatot is.
Kezelés
A H. pylori kezelésére többféle kezelési rend alkalmazható, és a kezelés szokásos időtartama 14 nap. A felhasznált gyógyszerek dózisa: protonpumpa-gátló (PPI, standard vagy kétszeres adag), klaritromicin naponta kétszer 500 mg, amoxicillin naponta egyszer, bizmut-szubszalicilát 300 mg/nap, metronidazol 500 mg/nap, tetraciklin 500 mg/nap, levofloxacin 500 mg/nap, rifabutin 300 mg QD.
A H. pylori miatt kezelt valamennyi beteget legalább négy héttel a kezelés befejezése után meg kell vizsgálni a felszámolás igazolására. Második vonalbeli terápiát kell előírni, ha az első vonalbeli kezelés sikertelen (2. ábra), és nem tartalmazhatja a metronidazol vagy klaritromicin ismétlését.18 mint például a gyomorfekély nyomon követése). Ha a H. pylori tenyészete nem áll rendelkezésre a rezisztencia kiértékeléséhez, vagy ha három ajánlott kezelés sikertelen volt, megfontolható a rifabutin alapú hármas terápia (PPI, rifabutin és amoxicillin) 10 napig. Ha a tünetek nem javulnak a H. pylori felszámolása után, akkor az endoszkópiát folytatni kell, ha még nem hajtották végre.
Bonyodalmak
A PUD szövődményei közé tartoznak a csillapodatlan tünetek, a vérzés, a perforáció, a behatolás, a gyomor kimeneti obstrukciója és a gyomor rosszindulatú daganata (adenokarcinoma és MALT lymphoma). A vérzés a leggyakoribb szövődmény, és a betegek körülbelül 15–20% -ánál fordul elő. A PUD az akut felső GI-vérzés nagy részét (körülbelül 40–60% -át) teszi ki.28 A felső GI-vérzés vészhelyzet, amely megköveteli a betegek értékelését és azonnali átvizsgálását. A vérzéssel küzdő beteg kiértékelésének korai szakaszában a GI-tanácsadó figyelmeztetése hasznos a kritikus betegek kezelésének összehangolásában. A kockázatrétegzéshez a Glasgow-Blatchford és a Rockall pontszámokat használták.29 A kezelés során létfontosságú a megfelelő újraélesztés IV folyadékokkal és vérkészítményekkel annak érdekében, hogy a cél hemoglobin értéke 7 felett maradjon.
Intravénás PPI-terápiát kell indítani minden olyan betegnél, akinek úgy gondolják, hogy a felső GI-je vérzik a bemutatáskor, mivel az IV PPI-k csökkentik annak kockázatát, hogy az endoszkópia során magas kockázatú stigmákat találjanak, és ezzel összhangban az újbóli vérzés kockázatát és a műtét szükségességét is. Úgy működnek, hogy növelik a gyomor intra pH-ját, ösztönzik a thrombocyta-aggregációt és biztosítják az alvadék stabilitását. A prokinetikus szerek, mint például az eritromicin vagy a metoklopramid, szintén tekinthetők az endoszkópos vizualizáció és a diagnosztikai hozam javításának.31 A korai endoszkópia, amelyet ideális esetben 24 órán belül végeznek, prognosztikai és terápiás eredményeket egyaránt nyújt. Az endoszkópia után ajánlott a PPI megkezdése vagy folytatása (IV, ha magas kockázatú vérzéses stigmákat találunk). Tanulmányok kimutatták, hogy a napi kétszer adott IV PPI ugyanolyan hatékony, mint egy folyamatos PPI csepegtetés32, 33 jelentős költségmegtakarítással. A visszatérő vérzés magas mortalitással jár, és ismételt endoszkópiát, angiográfiai embolizációt igényelhet intervenciós radiológia vagy műtét miatt.
A perforáció a PUD következő leggyakoribb szövődménye, amely a peptikus fekélyek 2–10% -ában fordul elő, és hirtelen súlyos hasi fájdalomként jelentkezhet, hemodinamikai instabilitással vagy sokkkal.35 A fizikai vizsga eredményei tartalmazhatnak kezdetben hiperaktív bélhangokat, amelyek csökkenhetnek és előrehaladhatnak. merev has, visszapattanással, ami peritonitisre utal. A képalkotás során a szabad levegő jelenléte támogatja ezt a diagnózist, és ebben a helyzetben kerülni kell az endoszkópiát. A műtét általában a perforált peptikus fekély választott kezelése. 3 Gyenge műtéti jelölt és 24 óránál hosszabb perforációjú betegeknél (vízoldható kontrasztvizsgálatok alapján) orvosi kezelés nazogasztrikus (NG) szívással, IV. Folyadékok, antibiotikumok és savszuppresszió lehetőség. A behatoló fekélyek a közeli szervekbe is erodálódhatnak, például hasnyálmirigybe, májba, epevezetékbe vagy vastagbélbe.
A gyomor kimeneti obstrukciója (GOO) a PUD másik szövődménye, és korai jóllakottsággal, puffadással, fogyással, emésztési zavarokkal, émelygéssel és hányással járhat. Fizikai vizsga esetén a gyomorban lévő csapdába eső levegő és folyadék miatt szukkuszos fröccs hallható. A GOO-val megnyilvánuló fekélyek gyakran a pylorus csatornában vagy a nyombélbimbóban helyezkednek el. Az orvosi terápia általában NG szívást és antiszekréciós terápiát foglal magában. A pylorus endoszkópos ballon dilatációja vagy a műtét lehetőségek a krónikus obstrukció enyhítésére
Következtetés
A PUD egy olyan betegség, amelynek klinikai terhe csökken, a H. pylori fertőzések csökkenése, valamint az antiszekréciós terápia jobb hozzáférhetősége és az NSAID-ok megfontoltabb használata miatt. Mindazonáltal a folyamatos magas életprevalenciája és a változatos klinikai megjelenés miatt a PUD felismerése és megfelelő kezelése kulcsfontosságú a jelentős szövődmények elkerülése és minimalizálása érdekében. A PUD értékelése során figyelembe kell venni a H. pylori tesztelését és kezelését, valamint az NSAID-ok által okozott nyálkahártya károsodásának korlátozását (egyidejű PPI-profilaxis vagy COX-2 szelektív NSAID-ok kiválasztása révén). Az újraélesztés, az antiszekréciós terápia, az endoszkópia és az antitrombotikus szerek kezelése a legfontosabb lépés a PUD-vérzés kezelésében, amely a leggyakoribb szövődmény.
Életrajz
MD Mechu Narayanan (bal felső sarokban) és Kavya M. Reddy (jobb felső sarokban) ösztöndíjasok, Elizabeth Marsicano (alul) pedig a gasztroenterológiai és hepatológiai osztály belgyógyász adjunktusa., Saint Louis Egyetem Orvostudományi Kar, St. Louis, Mo.
- Peptikus fekélybetegség (fekélyek) - gasztroenterológus
- Peptikus fekélybetegség - Rákterápiás tanácsadó
- Peptikus fekélybetegség ápolása és kezelése - Ápolási táblák
- PDF Futófej PEPTIC ULCER BETEGSÉG ORVOSI ÉS MŰTÉTI KEZELÉSEK - Ingyenes letöltés PDF
- Újszerű megközelítés a peptikus fekély perforációs műtétjén - Ahmadinejad - 2020 - Klinikai esetjelentések -