Oxysterol/chitotriosidase alapú szelektív szűrés N-típusú C-típusú Niemann-Pick esetében infantilis kolesztázisos szindrómás betegeknél
Absztrakt
Háttér
A C típusú Niemann-Pick-betegség (NP-C) egy örökletes neurodegeneratív betegség (100 000 újszülöttből 1/1), amelyet az NPC fehérjék károsodása okoz, és nem észlelt koleszterin felhalmozódáshoz vezet a késői endoszomális/lizoszómás rekeszekben. A mai napig az NP-C diagnosztika általában a fibroblasztok koleszterin detektálásán alapul, invazív és időigényes filippin festéssel, és további érvekre van szükségünk ahhoz, hogy az oxiszterolokat biomarkerként széles körben bevezessük az NP-C-be.
Mód
Amennyiben az NP-C az összes csecsemő-kolesztáz kb. 8% -át képviseli, ebben a prospektív megfigyelési vizsgálatban megpróbáltuk újra felmérni a plazma oxiszterol és kitotriozidáz specifitását, mint az NP-C biokémiai szűrővizsgálati markereit ismeretlen eredetű kolesztázisos szindrómában szenvedő gyermekeknél. 108 (2 hét és 7 év közötti) beteg esetében mértük a kolesztán-3β, 5α, 6β-triol (C-triol) és a kitotriozidáz (ChT) szintjét. Magas C-triol- és/vagy ChT-értékű betegeknél a NPC1 és NPC2 géneket Sanger-szekvenáltunk, és további 47 gént (az egyedi májkárosodási panelről) NGS-szekvenáltunk.
Eredmények
Megnövekedett C-triolszintet (> 50 ng/ml) 4 (108) ismeretlen eredetű cholestasis szindrómában szenvedő csecsemőben detektáltak, egy beteg molekuláris genetikai NP-C diagnózisát követve. A plazma koleszterinszintje szignifikánsan korrelál a C-triollal (o
Háttér
A C típusú Niemann-Pick-betegség (NP-C) egy ritka, progresszív neurodegeneratív betegség, amelynek előfordulási gyakorisága 89 000–150 000 élveszületésenként egy a nyugat-európai lakosság körében [1, 2]. Az NP-C esetek körülbelül 95% -át a NPC1 gén (18q11-q12 lokusz), körülbelül 5% -át a NPC2 gén (14q24.3 lokusz). Ezeknek a géneknek a kóros mutációi az intracelluláris koleszterin transzport károsodásához, majd a szabad koleszterin és lipidek felhalmozódásához vezetnek az endoszómákban és a lizoszómákban [2].
Az NP-C klinikai tünetei nagyon változóak, és három kategóriába sorolhatók: zsigeri, neurológiai és pszichiátriai [3]. A megnyilvánulások az újszülött korától (45–65%) az élet hetedik évtizedéig és az élet hetedik évtizedéig változnak [4,5,6].
Az NP-C legkorábbi klinikai tünetei az összes beteg közül az újszülöttkori kolesztázis szindróma, az izolált splenomegalia és a hepatosplenomegalia [1, 3, 7]. Néhány nemimmun hydrops és ascites esetről is beszámoltak [8, 9]. A legtöbb esetben az NP-C-vel kapcsolatos kolesztázis jelei spontán módon csökkennek az élet 6. és 8. hónapjára, míg a máj és/vagy a lép megnagyobbodása hosszú ideig fennáll [10].
Technikailag nehéz és időigényes filippin festés volt az alapvető diagnosztikai módszer az előző évtizedekben [11]. Mivel a modern NGS módszereket egyelőre nem tekintik szűrővizsgálati megközelítésnek (különösen az újszülöttek kolesztázisának magas előfordulási gyakorisága tekintetében 2500 újszülöttből 1 esetén) [3, 11, 12], az új biokémiai markerekre nagy szükség van az NP-C szűréshez.
A kitotriozidáz (ChT) az a makrofág-aktivációval összefüggő plazma által hordozott enzim, amelyet biomarkerként alkalmaztak egy lizoszómális tároló betegségben (LSD), beleértve a Gaucher-kórt (GD) és az NP-C-t is [13]. Ennek a markernek az NP-C specifitása azonban nem elegendő, pozitív a különböző állapotokban, beleértve a kolesztázist és a szisztémás autoimmun gyulladásos betegségeket. A ChT szintén nem informatív az egyének jelentős részében a gyakori funkcióvesztés-variáns miatt, ami homozigóta egyéneknél hiányos aktivitást, heterozigóta esetekben pedig hamis negatív eredményt eredményez. A közelmúltban a reaktív oxidatív anyagokat (ROS), a kolesztán-3β, 5α, 6β-triolt (C-triol) és a 7-ketokoleszterint (7-KC) megállapították megbízható és kényelmes diagnosztikai biomarkerként az NP-C számára [14,15, 16,17,18,19,20,21]. Az adatok (felnőtt betegek) azt mutatják, hogy a C-triol jó érzékenységgel és specifitással rendelkezik az NP-C szűrésre, míg a 7-KC korlátozott specifitással rendelkezik [11, 22].
A legújabb oxiszterolprofil vizsgálatok az oxiszterolok NP-C biomarkerként való viszonylag alacsony specificitását mutatják kolesztázisos szindrómában szenvedő csecsemőknél [23]. Amennyiben az NP-C az összes csecsemő-kolesztáz 8% -át képviseli [24], megpróbáltuk újraértékelni a C-triol és a ChT plazma kimutatásának specificitását a kolesztázisos szindrómában szenvedő csecsemők körében az NP-C szűrés céljából.
Mód
Etika és beleegyezés
Ezt a prospektív megfigyelési kohorszvizsgálatot az Orvosi Világszövetség Etikai Kódexének (Helsinki Nyilatkozat) szerint végezték, és a vizsgálati protokollt a Kulakov Országos Szülészeti, Nőgyógyászati és Perinatológiai Orvosi Kutatóközpont Etikai Bizottsága felülvizsgálta és jóváhagyta ( 13. jegyzőkönyv 2013. december 06-tól). Minden résztvevő (a gyermekek szülei) írásbeli beleegyező nyilatkozatot adott.
A betegek és a tanulmányterv
A vérmintákat 108 csecsemőről (2 hét és 7 év közötti), ismeretlen eredetű kolesztázisos szindrómáról (az élet első hónapjaiban dokumentálták) vették a Kulakov Országos Szülészeti, Nőgyógyászati és Perinatológiai Orvosi Kutatóközpontban (Moszkva, Oroszország) és Orvosi Genetikai Kutatóközpont (Moszkva, Oroszország) 2014 januárja és 2017 májusa között. A vérmintákat 4 ml BD Vacutainer K3EDTA csövekbe gyűjtöttük, 5 percig 3000 fordulat/perc sebességgel centrifugáltuk, és a plazmát az elemzésig - 80 ° C-on fagyasztottuk.
A betegeket két csoportra osztották a kolesztázis klinikai és laboratóriumi tüneteinek jelenléte vagy hiánya alapján a felvétel pillanatában: 1. csoport - csecsemők, akiknek kolesztázis klinikai és laboratóriumi tünetei voltak C-triol és ChT analízissel, és; 2. csoport - csecsemők, akiknek az oxiszterol mérése idején nincsenek kolesztázis/citolízis szindróma klinikai vagy laboratóriumi tünetei, de akik életük első hónapjaiban átmeneti kolesztázisban szenvedtek.
Az 1. csoportba 80 gyermek került (átlagéletkor 3,0 hónap, SD 1,7 hónap, 0,5–10 hónap). Az 1. csoport 65 gyermekének (81%) volt megnagyobbodott a máj az oxiszterol és a ChT mérésekor (átlag 4,3 cm, SD 1,6 cm, 2,5–8,0 cm) a középső clavicularis vonal mentén a borda szint alatt, és 71 ( 89%) volt splenomegalia (átlagosan 2,5 cm, SD 1,6 cm, 0,5–6,0 cm). A kolesztázis és a citolízis szindróma megnövekedett biokémiai markereit figyelték meg az 1. csoport összes gyermekében (1. táblázat).
A 2. csoportba 28 gyermek került (átlagéletkor 31,8 hónap, SD 28,0 hónap, 5-84 hónap), a kórelőzmények korábbi neonatális kolesztázisának részleteivel. A 2. csoportba tartozó összes gyermeknek az élet első hónapjaiban sárgasága és hepatomegalia volt. Húsz betegnél volt korábbi splenomegalia és acholikus széklet epizódja. A sárgaságmegszakítás átlagos életkora 3,7 hónap, SD 1,8 hónap (a széklet színének, a bilirubin szintjének, a GGT aktivitásának és a koleszterin szintjének egyidejű normalizálódásával). A vizsgálat idején kolesztázist nem észleltek, de hét gyermeknél kiderül a hepatosplenomegalia.
A megfigyelési időszak alatt az 1. vagy 2. csoportban nem észleltek májelégtelenség és portális hipertónia jeleit.
A megerősített NP-C eset klinikai leírása: a gyermek (XY) 39. héten született. Születéskor: súlya 3670 g, magassága 50 cm, Apgar 7/8, máj + 2–2,5 cm, lép 2 cm. 2. nap: sárgaság jelent meg. 4. nap: máj + 4–4,5 cm, lép 3,5–4 cm, össz. Víztartalom 124 mkM/L, irányv. 33 mkM/L, Alp 700 mkM/L, ALТ 173 U/L, AST 118 U/L, TORCH negatív, a portális hipertónia jelei nincsenek. A sárgaság 4 héttel megszűnt, a máj 6 hónappal csökkent (de a lép fokozatosan 5–5,5 cm-re nőtt). Izomhypotenziót észleltek a 8. héten. 12 hónap: némi késés a pszicho-motoros fejlődésben. 2,5 éves korban (amikor a betegnek a betegség kezdeti neurológiai jelei voltak) a Miglustat terápiát pozitív hatással kezdték. Családi anamnézis funkciók nélkül (testvérek - egészséges lány 7 éves).
Klinikai vizsgálat és általános laboratóriumi vizsgálatok
A vizsgálat magában foglalta: sárgaság jelenléte, széklet színe, viszketés, lépméret és májméret (cm-rel a jobb parti szint alatt és a jobb középső clavicularis vonal mentén). A laboratóriumi tesztek a következők voltak: teljes és közvetlen bilirubinszint, gamma-glutamil-transzpeptidáz (GGT) és alkalikus foszfatáz (ALP) enzimaktivitások, szérum koleszterin és trigliceridek, emelkedett transzaminázok (alanin-aminotranszferáz [ALT] és aszpartát-aminotranszferáz [AST] aktivitás) és májfunkciós tesztek. (albumin, kolinészteráz [CE], fibrinogén, protrombin idő és INR).
C-triol analízis
Az EDTA-plazma C-triolt dimetil-amino-butirát-észterként meghatároztuk minden beteg számára folyadékkromatográfiás tandem tömegspektrometriás (LC-MS/MS) elemzéssel, kis módosításokkal [25]. A kromatográfiás elválasztást Phenomenex Gold C18 oszlopon (2,1 × 100 mm, 5 μm) végeztük 5 mM ammónium-formiát és acetonitril lineáris gradiensével LC20 HPLC rendszeren (Shimadzu, Japán). Ezt követte a detektálás Sciex 3200 QTrap tömegspektrométeren (ABSciex, USA). D7-C-triolt használtunk belső standardként. A vizsgálat lineáris volt 0,5–200 ng/ml koncentrációtartományban. A napon belüli és vizsgálati variációk 2,3–9,6% és 3,8–11,8% (% CV) között változtak. A kvantifikáció (LOQ) és a kimutatás (LOD) határértékei 0,5 ng/ml, illetve 0,05 ng/ml voltak. A normál C-triol-érték 0-50 ng/ml volt [18, 26].
Lizoszomális enzimek aktivitása
Chitotriosidase assay
A ChT aktivitást az EDTA minták szűrőkártyáin készített szárított vérfoltok alapján mértük. Szabványos fluorometriai módszert alkalmaztunk, a leírtak szerint [27]. A ChT-értékek normál tartománya 2,5–100 nM/h/ml volt.
Béta-glükozidáz és szfingomielináz aktivitások
A béta-glükozidáz és a szfingomielináz aktivitásokat a multiplex elemzés részeként határozták meg, a közzétett protokoll szerint, néhány módosítással [28]. A tömegspektrometriát egy API 3200 QTrap tandem tömegspektrométeren (ABSciex, USA) végeztük, több reakciót monitorozó (MRM) módban. A méréseket a Center for Disease Control (CDC; Atlanta, USA) -ból származó ismert enzimaktivitású kontrollmintákra standardizáltuk.
Molekuláris genetikai elemzés
A mutációelemzést a betegek vérmintáinak DNS-ével végeztük. Egzonok és határoló régiói NPC1 és NPC2 a géneket eredeti PCR primerekkel (2. táblázat) amplifikáltuk, és az ABI PRISM 3500xL genetikai elemzővel (Applied Biosystems, USA) szekvenáltuk standard BigDye kémia segítségével.
A testreszabott Ion AmpliSeq DNS panelben szereplő gének exonjai és határoló régiói (ABCB11, ABCB4, ABCD3, AGL, AKR1D1, ALAD, ALDOB, ATP7B, ATP8B1, C10orf2, CYP7B1, DGUOK, FAH, FBP1, G6PC, GAA, GALE, GALT, GBE1, GYS2, HADHA, JAGI, LIPA OTC, PFKM, PGAM2, PGM1, PHKA2, PHKB, PHKG2, POLG1, PYGL, SERPINA1, SLC25A13, SLC37A4, TALDO1, TJP2, BCS1L, NBAS, SERAC1, TRMU, SCO1, LARS, SMPD, és GBA) amplifikálta az Ion AmpliSeq ™ Library Kit 2.0 és szekvenálta az Ion Torrent PGM ™ rendszeren (Thermo Fisher Scientific, USA). A referencia genomhoz való igazítást és a különbségek keresését a szerver Torrent Suite, a Variant Caller plugin segítségével végeztük.
Adatelemzés
A statisztikai elemzéshez a Statistica-t (10. verzió, StatSoft Inc., USA) és az RStudio Desktop-ot (1.2.1335-ös verzió, RStudio, USA) használtuk. Az eredményeket leíró statisztikák segítségével mutatjuk be (számtani átlag ± szórás, tartományok (minimum – maximum) és adott esetben kvartilisek). A plazma C-triol és koleszterin korrelációhoz Pearson és Spearman korrelációs módszereket alkalmaztak. Az r értékek statisztikai szignifikanciáját kétfarkú 5% -os szinten feltételeztük.
Eredmények
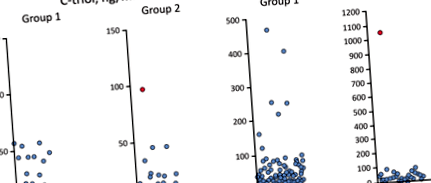
Amint azt a 3. táblázatban megfigyeltük, a C-triolszint emelkedett három betegnél és a ChT - az 1. csoportból származó hét betegnél (egy beteg mind a C-triolt, mind a ChT-t mutatja) (1. ábra). A 2. csoportban megnövekedett C-triol- és ChT-értékeket figyeltek meg egy olyan betegnél, akit molekuláris genetikai vizsgálatokkal később diagnosztizáltak NP-C-vel.
A C-triol koncentráció és a ChT aktivitás megoszlása. Lábjegyzet: A piros árnyékolással ellátott adatpont az NP-C beteget jelöli
Mind az 9, emelkedett plazma C-triol- és/vagy ChT-pácienst az 1. csoportból és egyet a 2. csoportból mutációkat elemeztük. NPC1, NPC2 és további 47 májkárosító panel gén (lásd fent). 4 (10 betegből) klinikailag releváns mutációt detektáltak, köztük új heterozigóta JAG1 feltehetően örmény eredetű mutáció (3. táblázat). A 3. és 10. számú betegeknél a vegyület heterozigozitását az ősök szekvenálása igazolta.
Minden magas ChT-szinttel rendelkező betegnél a lizoszomámsav lipáz, a béta-glükozidáz és a szfingomielináz tartománya normális a szárított vérfoltokban (az adatokat nem mutatjuk be). A lineáris regresszióanalízis statisztikailag szignifikáns pozitív korrelációt mutatott a koleszterin és a C-triol szintek között az 1. csoportban (r = 0,69, o 0,05) (2. ábra). Az 1. csoport koleszterin- és C-triolszintjének korrelációját nem-parametrikus Spearman-korrelációs teszttel (ρ = 0,586, o 2. ábra
A C-triol és a vér koleszterinszintje közötti korrelációs elemzés. Lábjegyzet: A folytonos piros vonalak a legkisebb négyzetes regressziós vonalak; a pontozott piros vonalak a 95% -os konfidencia intervallumot képviselik
Vita
A C-triol a koleszterin oxidatív származéka, amely potenciálisan megemelkedhet a különféle etiológiák hiperkoleszterinémiája miatt (beleértve a kolesztázis szindrómát is).
Egy korábbi prospektív kohorszvizsgálatban Polo és mtsai. értékelte a C-triol és a 7-KC specifitását súlyos kolesztázisban szenvedő és feltételezett NP-C-vel rendelkező újszülöttekben [23]. Mindkét oxiszterol marker szintje 6/7 betegnél szignifikánsan magasabb volt az egészséges kontrollokhoz képest, de az NP-C genetikai diagnózisát csak 1/6 betegnél igazolták. Biliáris atresiát diagnosztizáltak a másik öt magas oxiszterolszintű betegnél, és az egyiknél a legalacsonyabb mért oxiszterolszint átmeneti újszülöttkori kolesztázisban szenvedett. A tesztalanyok között nem volt összefüggés az oxiszterol szintje és a közvetlen bilirubin között. A kolesztatikus májbetegségben szenvedő felnőttek további kontroll csoportja 5/15 esetben mutatott magas oxiszterolszintet, és két esetben a szint szignifikánsan meghaladta a normális tartományt. Arra a következtetésre jutottak, hogy a kolesztázisban szenvedő újszülöttek között, ahol az NP-С nem volt megerősítve, a megnövekedett oxiszterolszint összefüggésben állt a kolesztázissal járó oxidatív stresszel, de nem volt specifikus az NP-C-re. Ez a hipotézis összhangban volt korábbi tanulmányokkal, ahol az oxiszterol szintjét hepatitis C vírusfertőzésben szenvedő felnőtteknél mérték [29, 30].
Ebben a tanulmányban az 1. csoportba tartozó újszülöttek és csecsemők szoros összefüggést mutatnak a C-triol és a koleszterin szint között. C-triol- vagy ChT-mérésekből hamis pozitív eredményeket fedeztek fel 9 (11,3%) kolesztázisos szindrómás betegnél a mérés idején (1. csoport). Mindegyik esetben ezek a megállapítások veleszületett és/vagy örökletes májbetegségekhez kapcsolódtak, amelyek különböző súlyosságú kolesztázissal társultak. A C-triol és a ChT növekedését a 2. csoportban csak egy gyermeknél észlelték, akiben a koleszterinszint normális volt, és akit később diagnosztizáltak NP-C-vel. Más veleszületett betegségeket számos olyan beteg igazolt, akiknél ezek a biomarkerek megemelkedtek. Így a plazma oxiszterolok és a ChT együttes értékelése (esetleg más biomarkerekkel, például lizoszfingolipidekkel és specifikus epesavakkal együtt [31]), különösen azokban az esetekben, amikor a koleszterinszint nem emelkedett, hasznos szűrővizsgálati módszer lehet az új NP-C esetekben, és segíthet a molekuláris genetikai vizsgálatra jelentkezők felderítésében.
Következtetés
Mint számos örökletes neurodegeneratív betegség esetében, az új esetek korai felismerése különösen fontos az NP-C esetében, mivel léteznek olyan célzott terápiák, amelyek képesek lassítani a neurológiai romlást. A ChT aktivitás és a C-triol szint kombinált elemzése hatékony módszer lehet az NP-C azonosítására, de az újszülöttkori kolesztázis összefüggésében a pozitív prediktív érték alacsony. Vizsgálatunk fő korlátja, hogy csak egy betegnél diagnosztizáltak NP-C-t (a 2. csoportban korábban újszülöttkori kolesztázisban szenvedő betegek).
- Szelektív és érzékeny szonda oligonukleotiddel fedett nanoporózus alumínium-oxidban a gyors
- Költségvetési kihíváson alapuló üzem - 4 fős család - 1. hét - Költségvetésen alapuló üzem
- Növényi alapú fogyás 6. nap - Tina Redder - Igaz étel
- Elhízás és 2. típusú cukorbetegség a fiatalokban A nemzeti aggodalom kérdése AJMC
- Az elhízás a 2-es típusú cukorbetegség kialakulásának csaknem 6-szoros megnövekedett kockázatához kapcsolódik, genetikai és