Metabolikus rugalmasság az egészség és a betegségek terén
Összegzés
Az anyagcsere-rugalmasság az a képesség, hogy reagáljon vagy alkalmazkodjon az anyagcsere-igény feltételes változásaihoz. Ezt a tág fogalmat az inzulinrezisztencia és a glükóz és a zsírsavak közötti üzemanyag-kiválasztást szabályozó mechanizmusok kifejtésére használták, kiemelve az elhízás és a 2-es típusú cukorbetegség metabolikus rugalmatlanságát. Ezzel párhuzamosan a korszerű testedzés-fiziológiai kutatások segítettek azonosítani az elhízás és a cukorbetegség megváltozott üzemanyag-anyagcseréjét. Az „omika” technológiák fejlődése tovább ösztönözte további alap- és klinikai-transzlációs kutatásokat a csontvázizom és a zsírszövet metabolikus rugalmasságának javítását szolgáló mechanizmusok további vizsgálata céljából, amelynek célja az anyagcsere-betegségek megelőzése és kezelése.
Mi az anyagcsere rugalmassága?
Az anyagcsere-rugalmasság leírja az organizmus azon képességét, hogy reagáljon vagy alkalmazkodjon az anyagcsere- vagy energiaigény változásai, valamint az uralkodó körülmények vagy aktivitás függvényében. Először olyan kifejezésként használták, amely leírja a parazita férgek helmintjeinek megnövekedett képességét kémiai energia és kulcsfontosságú metabolitok előállítására aerob módon vagy anaerob légzéssel, hogy nagyobb sokoldalúságot és anyagcsere-rugalmasságot biztosítson, hogy reagáljon és alkalmazkodjon az élőhely környezeti változásaihoz. (Kohler, 1985).
Az anyagcsere rugalmasságának elterjedtebb fogalmát az üzemanyag kiválasztásának összefüggésében hirdették meg az éhgyomortól a táplált állapotig tartó átmenet során, vagy az éhezéstől az inzulinstimulációig az inzulinrezisztencia magyarázata érdekében (Goodpaster és Kelley, 2008). Az eredeti Randle-ciklust (Randle és mtsai., 1963) alapelvként fogalmazták meg az inzulinrezisztencia és a 2-es típusú cukorbetegség mögött meghúzódó zsírsav-oxidáció és csökkent glükóz-oxidáció magyarázata érdekében. Kelley és Mandarino később átgondolta ezeket a koncepciókat, miután elegáns in vivo végtag-egyensúlyi tanulmányokat mutatott be, amelyek bemutatták az anyagcsere rugalmatlanságát az emberi 2-es típusú cukorbetegségben és az elhízásban, amelyekben a posztabszorpciós körülmények között a vázizomzatnak megemelkedett a glükóz-oxidációja, és kölcsönösen csökkent a zsírsav-oxidációja ( Kelley, 1994, 1993; Kelley és Mandarino, 1990; Kelley és mtsai, 1993). Az első kísérletek leírása óta az anyagcsere-rugalmasság kifejezés úgy alakult, hogy magában foglalja más anyagcsere-körülményeket és szöveteket, és tágabban utal fiziológiai alkalmazkodóképességre. Az anyagcsere-rugalmasságról arra is következtetett, hogy szövetspecifitással rendelkezik az éjszakai és a napi éhomi és táplált állapotokra reagálva (Kelley et al., 1999).
A testmozgás egy másik élettani állapot, amely megköveteli az anyagcsere rugalmasságát annak érdekében, hogy az üzemanyag rendelkezésre állása és az anyagcsere gépei megfeleljenek az energiaigény hatalmas növekedésének. A testmozgás időtartama és intenzitása mind mélyrehatóan befolyásolhatja az energiaigényt, ezáltal nagyon különböző módon megadóztathatja az energiatárolókat és a katabolikus utakat. Bár a testmozgás okozta anyagcsere-változások témáját a legutóbbi áttekintések tárgyalták (lásd (Egan és Zierath, 2013; Hawley és mtsai, 2014)), a testmozgással járó anyagcsere-rugalmasság alapjául szolgáló mechanizmusok további vizsgálatokat érdemelnek. Az „izomplaszticitást” először (Pette, 1980) használták az izom azon képességének jellemzésére, hogy reagáljon a különféle ingerekre, és tartalmazott egy anyagcsere-rugalmasságot. A testedzés megváltoztathatja az üzemanyag tárolását és rendelkezésre állását, valamint a legújabb bizonyítékok arra vonatkozóan, hogy a testmozgás elősegíti a vázizom epigenómájának (Rasmussen és mtsai, 2014), a transzkriptóm (Keller és mtsai, 2011; Raue és mtsai, 2012) és a proteóm (Hoffman) változását et al., 2015), amelyek mindegyike anabolikus rugalmasságot jelent annak érdekében, hogy megfeleljen az egyes testmozgások vagy tevékenységek energiaigényének változásainak, mélyebb vizsgálatokat érdemelnek az anyagcsere rugalmasságát ösztönző molekuláris mechanizmusok.
A metabolikus rugalmasság ezen általános koncepcióinak bármilyen áttekintése vagy megvitatása megérdemli, hogy valamilyen kontextusba és keretbe kerüljön; mert enélkül a felülvizsgálat túl széles és nehézkes lehet. Áttekintjük az éhségre és táplálkozásra, valamint a pihenéstől a testmozgásig tartó egészséges metabolikusan rugalmas válaszok folyamatait és néhány mögöttes mechanizmusát, valamint következtetni fogunk az anyagcsere rugalmatlanságára, mivel az összefügg a kórélettel. Ebben az összefüggésben áttekintjük azokat a bizonyítékokat, amelyek szerint a testedzés javíthatja az anyagcsere rugalmasságát, ami nagyon fontos az elhízás, a 2-es típusú cukorbetegség és az öregedés kóros fiziológiai aspektusainak javításához. Megpróbáljuk összefoglalni azokat a bizonyítékokat is, amelyek összehasonlítják és szembeállítják a testedzés és a kalóriakorlátozás okozta súlycsökkenés anyagcsere-rugalmasságra gyakorolt hatásait, és ennek valószínűsíthető következményeit ezen állapotok megelőzésére és kezelésére.
Hangsúlyozzuk a vázizomzat és a zsírszövet szerepét az anyagcsere rugalmasságában az emberekben. Ez két szövet, amelyek döntő szerepet játszanak az energia-anyagcserében, és mindkettő biopsziás embereknél hozzáférhető, hogy megvizsgálják biológiájukat, valamint az akut és krónikus beavatkozásokra adott reakciókat. A szövetektől függetlenül az anyagcsere rugalmasságát a sejtek és az organellák folyamata vezérli, talán leginkább a mitokondriumokban. Itt mérlegeljük az anyagcsere rugalmasságát az éhezés, az inzulinstimuláció és a testmozgás megfelelő körülményei között. Megvitatjuk az anyagcsere rugalmasságának néhány olyan aspektusát is, amelyeket in vitro újra kapituláltak.
Böjt etetéshez - Inzulinrezisztencia az anyagcsere rugalmatlanságának részeként elhízás és 2-es típusú cukorbetegség esetén
A vázizom hajtja az üzemanyag katabolizmusát
Az eredeti végtag-egyensúlyi közvetett kalorimetriás technika, amelyet Andres és munkatársai hoztak létre 1956-ban, utóabszorpciós körülmények között mért glükóz- és zsírsav-oxidációt az alkar izomzatának légzőkészülékén (RQ) keresztül (Andres et al., 1956). Világosan bebizonyították, hogy a böjtből az etetésbe való normális, egészséges átmenet az üzemanyag-választás elmozdulását jelenti a túlnyomórészt oxidatív zsírsav-anyagcserétől a vázizomzat nagyobb glükóz-oxidációjáig. Kelley és munkatársai később bebizonyították, hogy ez a váltás - bár mennyiségileg kisebb mértékben - magában foglalta a glikolitikus energiatermelés növekedését is (Kelley és mtsai, 1999).
Mivel az energiafogyasztás, főleg az ételek termikus hatása miatt, kevesebb, mint 10% -kal nő (Acheson et al., 1984), ez a szubsztrátváltás az energiaforrások hatékony felhasználását szolgálja az étkezés makrotápanyagainak tartalma vagy keveréke alapján. Ennek a szubsztrátváltásnak az elsődleges célja a katabolikus folyamatokról az anabolikus folyamatokra való áttérés, amelyek során az energia hatékonyan tárolható a vázizomban, a zsírszövetben és a májszövetekben. Az étkezés hatására az inzulin felszabadulása ennek a váltásnak a fő mozgatórugója.
Az anyagcsere-rugalmasság körüli figyelem nagy része annak köszönhető, hogy az inzulinrezisztenciában szerepet játszik, ezt a koncepciót először Wilhelm Falta fejlesztette ki, és Bécsben adták ki 1931-ben, mint a 2-es típusú cukorbetegség lehetséges kiváltó okát (Falta és Boller, 1931). Az ezt követő 85 év alatt az inzulinrezisztencia úgy alakult, hogy általánosan elfogadottá vált, mint a 2-es típusú cukorbetegséghez vezető domináns tényező, és az elhízást, a 2-es típusú cukorbetegséget és a szív- és érrendszeri betegségeket összekötő metabolikus szindróma néven ismert kardiometabolikus kockázati tényezők konstellációja között a legvalószínűbb egyetlen kapcsolat. (Reaven, 1988).
Vázizom inzulinrezisztencia és zsírsav anyagcsere
Az inzulinrezisztencia kulcsfontosságú eleme az anyagcsere rugalmatlanságának, amely számos szövetben és szervben kialakulhat. Az inzulinrezisztencia sejtmechanizmusait alaposan áttekintették (Flier et al., 1979; Holland és Summers, 2008; Shulman, 2004). A máj és a vázizom inzulinrezisztenciájának alapját képező mechanizmusokra jelentős hangsúlyt fektettek a károsodott mitokondriális zsírsav oxidáció és a lipid metabolitok, a diacilglicerin és a ceramidok felesleges felhalmozódásának szerepére.
A csontvázizomzat
Az inzulin hatására a glükóz metabolizmus növekedésének 60–80% -a (Ng et al., 2012), és egy hatalmas munka támogatja a vázizom inzulinrezisztenciájának ok-okozati szerepét a 2-es típusú cukorbetegségben (DeFronzo és Tripathy, 2009; Petersen és mtsai., 2007). Intuitív módon az izomsejtekbe és az adipocitákba a véráramból bejutó glükóz mennyiségének csökkenése, valamint a máj glükóztermelésének csökkentett szuppressziója emeli a vér glükózszintjét a hasnyálmirigy béta sejtjeinek megfelelő inzulin felszabadulásának hiányában. . Az érvelés szerint a cukorbetegség akkor alakul ki, ha és amikor a béta-sejtek nem képesek megfelelő inzulinszekrécióval kompenzálni ezt az inzulinrezisztenciát.
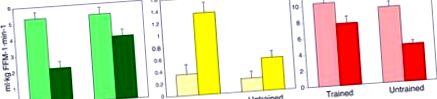
Hiperinzulinémiás-euglikémiás „glükóz” bilincs alatt (világos oszlopok) vagy (sötét csíkok) intralipid együttes infúzióval az edzett személyek csökkentik a glükóz oxidációját (zöld oszlopok), növelik a zsírsav oxidációt (sárga oszlopok) és megőrzik az izmok glikogén tárolását ( vörös sávok) képzetlen alanyokhoz viszonyítva, akik anyagcsere-rugalmatlanságot mutatnak. Más szavakkal, a képzetlen alanyok nem csökkentik hatékonyan a glükóz-oxidációt vagy nem növelik a zsírsav-oxidációt, és csökkentik a glikogén-tárolást a lipid-túlterhelés esetén. Az adatokat (Dube és mtsai, 2014).
A fehér zsírszövet összehangolja az üzemanyagáramlást
A 2. ábra a WAT metabolikus alkalmazkodóképességének hatását mutatja be, hogy befolyásolja az anyagcserét más szövetekben, például vázizmokban. A lipolízis tompa elnyomása az inzulinnal egy hiperinsulinémiás-euglikémiás bilincs alatt egészséges emberek glikolitikus katabolizmusának és anyagcsere-rugalmasságának csökkenésével jár (2a) (Sparks és mtsai, 2009), és a cukorbetegség státusza alapján különít el, nem pedig a zsírtömeg (2b) (publikálatlan adatok). Az éjszakai böjt magas lipolitikus aktivitást vált ki WAT-ban az FFA-k erőteljes ellátása érdekében (Frayn és mtsai., 1996), és a vázizomzatban arányosan magas arányú zsír-oxidáció (alacsony RQ), ez a képesség tompul a 2. típusú családtörténetben szenvedő egyéneknél. cukorbetegség (Ukropcova et al., 2007). A WAT (EC50) inzulinérzékenységének összefüggésében (Nurjhan és mtsai., 1986) alacsony inzulinszintre van szükség ahhoz, hogy a WAT megfeleljen az éhínség okozta FFA-k iránti igénynek. Ha az inzulinszekréció oszcillációi gyengülnek és/vagy hiányoznak, például olyan embereknél, akiknek családi kórtörténetében 2-es típusú cukorbetegség szerepel (Matthews, 1996; O'Rahilly et al., 1988), a WAT adaptív válaszként vagy védekezésként kialakíthatja az inzulinrezisztenciát. mechanizmus annak érdekében, hogy szükség esetén folytathassák az FFA-k ellátását a vázizomzatba és más szövetekbe. A patobiológiát ezért feltételes összefüggés nélkül nehéz meghatározni.
a) A szabad zsírsavak (FFA-k) egy hiperinsulinémiás-euglikémiás bilincs alatt, 3-4 órán keresztül 80 mU/m 2/perc alapú folyamatos inzulin infúzióval, 56 egészséges populációban csökkent metabolikus rugalmassággal (delta RQ) függenek. a fiatal férfiak az anyagcsere-rugalmasság kvartilisekre oszthatók. b) A 2-es típusú cukorbetegségben (T2D; n = 18) szenvedő embereknél a hiperinsulinémiás-euglikémiás bilincs alatt szignifikánsan magasabb az FFA-szint, 100-300 órán át tartó, folyamatos inzulin infúzióval 100 mU/m 2/perc 3-4 órán keresztül, összehasonlítva az életkorral és a BMI-vel párosított egészséges emberek (ND; n = 6) és a nagyon aktív emberek (Aktív; n = 8). Az ANOVA-t alkalmazták a metabolikus rugalmasság kvartilisei közötti különbségek tesztelésére (delta RQ), post-hoc teszteléssel, a Tukey – Kramer HSD alkalmazásával a különböző csoportok közötti egyenlőségi kontraszt segítségével; alfa = 0,05. Az I. típusú hibaarányt előzetesen p értékre állítottuk be. A 3. ábra elegánsan szemlélteti a WAT anabolikus képességét. A 24 órán át tartó három étkezés során a hasi elhízású férfiaknál lényegesen alacsonyabb a WAT transzkapilláris fluxusa (nettó zsírraktározás és felszabadulás) a WAT-ból (McQuaid et al., 2011). Intuitív módon, mivel kevesebb étkezési FFA-t fokozatosan tárolnak a WAT-ban minden étkezés során, ezek az FFA-k a forgalomban maradnak, és valószínűleg ektopikusan lerakódnak más szövetekben, és metabolikus zavarokhoz vezetnek bennük. A 4. ábra az étkezés utáni RQ (tehát több szénhidrátot, mint zsírt éget) fokozatos növekedését mutatja be a 3 étkezés 3-dikjával 24 órás periódus alatt sovány egészséges egyénekben (nem publikált adatok). Az egészséges állapotban lévő szövetek közötti koordinált anyagcsere-rugalmasság lényege azt diktálja, hogy minél több zsír kerül tárolásra (és inert módon elkülönül) az étkezés utáni WAT-ban, annál kevesebb zsír áll rendelkezésre más szövetek katabolizmusához, ami nagyobb mértékben támaszkodik a szénhidrát-oxidációra ( magasabb RQ).
A testedzés és a kalóriakorlátozás által kiváltott fogyás hatása az anyagcsere rugalmasságára
A zsírtömeg csökkentése a WAT műtéti eltávolításával (zsírleszívás) nem eredményez metabolikusan előnyös eredményeket (Klein et al., 2004), rámutatva a WAT kalória-korlátozás által indukált és/vagy testmozgás által indukált átalakításának szükségességére. anyagcsere-javulás érhető el a zsírszöveten belül. Kevéssé ismert a testmozgás metabolikus rugalmasságra gyakorolt hatása (az inzulin és az akut testmozgás reakciókészsége szempontjából), valamint a WAT kapcsolódó molekuláris mechanizmusai. A kalória-korlátozás által indukált súlycsökkenés szélesebb hatással van a WAT-ban lévő transzkriptómra, összehasonlítva a kalória-korlátozással és a testmozgással (Lam et al., 2016). További vizsgálatok indokoltak annak megállapítására, hogy a testedzésnek és a fogyásnak lehetnek-e olyan közös aláírásai, amelyek javítják a mitokondriális funkciót, hatékonyságot vagy csökkentik az oxidatív stresszt, fokozott metabolikus rugalmassággal egyidejűleg.
Az anyagcsere-rugalmasság lehet-e cél a betegségek megelőzésére vagy kezelésére?
Az anyagcsere rugalmassága számos utat és mechanizmust ölel fel. Annak érdekében, hogy egy cél elérhesse az üzemanyag-kiválasztás vagy az energiafelhasználás megváltoztatását, az anyagcsere-rugalmasság vagy legalábbis ezek alkotóelemei életképes célpontok lehetnek a terápiában. Hatalmas erőfeszítéseket tettek az anyagcsere rugalmasságának megváltoztatására az elhízás és a cukorbetegség esetében. Kulcsfontosságú vita ezen a területen az, hogy az üzemanyag-választás változásai az energiaigény egyidejű növekedése nélkül terápiásnak bizonyulnak-e a tápanyag-túlterhelés vagy az elhízás esetén (lásd Muoio (Muoio, 2014) áttekintését. Például a mitokondriális zsírsav fluxus növelése és az oxidáció (Bruce és mtsai, 2009) vagy nem (Koves és mtsai, 2008) javíthatja az inzulinrezisztenciát. Azonban egyik stratégia sem növeli az energiafelhasználást vagy a keresletet (mint például a testmozgás). Egyszerűen fogalmazva, míg a szubsztrát anyagcseréjét megváltoztató stratégiák vagy az anyagcsere-rugalmasság hatással lehet az elhízásra és az anyagcsere-betegségekre a tápanyag-túlterhelés összefüggésében, az energiaigény egyidejű növekedése nélkül nem jelentenek valódi testmozgást.
Záró megjegyzések
Az anyagcsere-rugalmasság tág fogalma évtizedek óta vizsgálja az energia rendelkezésre állását és az üzemanyag-választást befolyásoló tényezőket és mechanizmusokat. A korai munka nagy része az inzulinrezisztencia megértésére irányult a vázizomzatban és a zsírszövetekben, az általános metabolikus rugalmatlanság részeként. Újabb tanulmányok vizsgálták az izom- és zsírsejtek anyagcsere-rugalmasságát, valamint szerepüket az általános anyagcsere-rugalmasságban. A táplálékhoz (vagy inzulinstimulációhoz), a testmozgáshoz való pihenéshez vagy a testedzéshez szükséges beavatkozások zsír- és izombiopsziával végzett vizsgálatokból kiderült, hogy fontos mechanisztikus nyomok támasztják alá az anyagcsere rugalmasságát az emberekben, az 5. ábra összefoglalva. Folytatni kell az inzulinrezisztencia és az anyagcsere rugalmatlanság mechanizmusainak és lehetséges kezelésének felkutatását, ideértve a zsírsav oxidáció képességét, az elhízást, a 2-es típusú cukorbetegséget és a kapcsolódó állapotokat.
A csontvázizom az alvási/utóabszorpciós körülmények közötti magasabb zsírsav-oxidáció sebességéről átáll az etetés utáni nagyobb oxidációra és a glükóz tárolására, valamint a csökkentett zsírsav-oxidációra. A zsírszövet a magasabb lipolízis sebességről a lipolízis elnyomására és a zsírraktározásra vált az éhezés és a táplálás közötti átmenet során. A pihenéstől a testmozgásig a vázizmok mind a zsírsav-, mind a glükóz-oxidáció sebességét növelik, hogy támogassák a magasabb energiaigényt, míg a zsírszövetben a lipolízis drasztikusan fokozódik.
Köszönetnyilvánítás
Őszinte hálánkat fejezzük ki Dr. David E. Kelley-nek és Dr. Steven R. Smith-nek, akik mélyen alakították az anyagcsere-rugalmassággal kapcsolatos gondolatainkat az elmúlt 20 évben. Ezúton is szeretnénk köszönetet mondani sok másnak, akik hozzájárultak az áttekintésben kiemelt tanulmányokhoz és koncepciókhoz. Végül köszönetet mondunk Dr. Elvis Carnerónak az adatokhoz nyújtott segítségért és az anyagcsere-rugalmasság ábrájának elkészítéséhez az egész helyiség kalorimetriájával. A szerzőket az Országos Egészségügyi Intézetek és az Amerikai Diabétesz Szövetség támogatásai támogatják.
Lábjegyzetek
Kiadói nyilatkozat: Ez egy szerkesztetlen kézirat PDF-fájlja, amelyet kiadásra elfogadtak. Ügyfeleink számára nyújtott szolgáltatásként a kéziratnak ezt a korai változatát biztosítjuk. A kézirat átmásolásán, szedésén és a kapott bizonyíték felülvizsgálatán átesik, mielőtt a végső hivatkozható formában közzétennék. Felhívjuk figyelmét, hogy a gyártási folyamat során olyan hibákat fedezhetnek fel, amelyek befolyásolhatják a tartalmat, és a naplóra vonatkozó minden jogi felelősségvállalás vonatkozik.
- A magas cukortartalmú étrend károsíthatja az anyagcserét és az anyák gondozását a terhesség után EurekAlert! Science News
- Magas rosttartalmú ételek és emésztési egészség Többé-kevésbé diéta vs betegség
- Az orvosi genetika örökletes metabolikus betegség osztálya Stanford Medicine
- Az egészség több, mint a betegség hiánya A megfelelő táplálkozás kritikus része az egyenletnek
- Vesebetegség gyermekeknél Gyermek Nephrology Duke Health