Helicobacter pylori–Fogadó sejt interakciók, amelyeket a IV-es típusú szekréció közvetít
Molekuláris Biológiai Intézet, Oregoni Egyetem, Eugene, OR 97403, USA.
Molekuláris Biológiai Intézet, Oregoni Egyetem, Eugene, OR 97403, USA.
Molekuláris Biológiai Intézet, Oregoni Egyetem, Eugene, OR 97403, USA.
Molekuláris Biológiai Intézet, Oregoni Egyetem, Eugene, OR 97403, USA.
Összegzés
Helicobacter pylori egy emberspecifikus gyomor-kórokozó, amely a világ népességének több mint felét kolonizálja. Ennek a baktériumnak a fertőzése a gyomor patológiáinak spektrumához kapcsolódik, az enyhe gyomorhuruttól a peptikus fekélyekig és a gyomorrákig. A súlyos betegség kimenetelének erős előrejelzője a cag (citotoxinnal társított gén) patogenitási sziget (PAI), egy 40 kb méretű DNS szakasz, amely a IV-es típusú szekréciós rendszer (TFSS) több komponensének homológjait kódolja. Egy gén a cag PAI, cagA, kimutatták, hogy a TFSS szubsztrátumát kódolja, amely gazdasejtekké transzlokálódik, és több változást okoz a gazdasejt jelzésében. Itt áttekintjük a IV. Típusú szekréció jellemzésének legújabb fejleményeit, a TFSS CagA és CagA-független hatásainak aktivitását, amelyek hozzájárulnak a H. pylori patogenezis.
Helicobacter pylori és az emberekkel való társulásai
Az emberi gyomorbiopsziáktól való elkülönítése óta 1983-ban (Marshall és Warren, 1984), H. pylori az intenzív kutatási tevékenység középpontjában állt. Először a peptikus fekélybetegség fertőző okaként fedezték fel, H. pylori azóta sokkal változatosabb és árnyaltabb kapcsolatban van emberi gazdájával (Blaser és Atherton, 2004). Ma már tudjuk, hogy a fertőzés a betegség kimenetelének spektrumával jár. A világ népességének több mint fele fertőzött H. pylori, a legmagasabb arány a fejlődő országokban (Rothenbacher és Brenner, 2003). A fertőzések kora gyermekkorban fordulnak elő, és évtizedekig tartanak célzott antimikrobiális terápia hiányában. Míg sokan H. pylori a fertőzött egyének klinikailag tünetmentesek, a legtöbb esetben bizonyos fokú gyomorhurut jelentkezik. A fertőzött személyek körülbelül 10% -ánál súlyosabb gyomorbetegségek, például peptikus fekélybetegség és atrófiás gastritis alakulnak ki. A gyomorrák a fertőzött személyek körülbelül 1% -ában alakul ki, ez az összefüggés az Egészségügyi Világszervezet nyilatkozatára késztette H. pylori az első bakteriális 1. osztályú karcinogén 1994-ben.
Tanulmányok H. pylori nem csak azt mutatták ki, hogy képesek hosszú évtizedekig együtt élni egyetlen gazdán belül, hanem azt is, hogy a faj az emberi történelem nagy részében együtt élt gazdájával. Valójában a szekvencia polimorfizmus mintái H. pylori izolátumokat használtak az emberi vándorlás mintázatának nyomon követésére (Falush et al., 2003). Az egyik nézet H. pylori az emberekkel való állandó együttélés ezt feltételezi történelmileg H. pylori komenzáció volt, és csak a közelmúltban vált patogénebbé a modern körülmények miatt (Blaser és Atherton, 2004). Ezek közé tartozik a várható élettartam növekedése, a közelmúltbeli változások az emberi étrendben, valamint a modern higiénia és az antibiotikumok megjelenése miatt megváltozott emberi immunológiai válaszok. Akár kórokozóként, akár kommensálként tekintenek rá, H. pylori egyértelműen lehetősége volt bonyolult mechanizmusok kifejlesztésére, hogy manipulálják gazdái sejtjei jelátviteli útjait.
Helicobacter pylori kísérleti modellek és kihívások
A részletek tanulmányozása cag A PAI által közvetített gazdasejt – baktérium kölcsönhatások, sok kutató szöveti tenyésztési modellt alkalmazott, leggyakrabban a gyomor adenocarcinoma vonal AGS-t. Bár az ilyen modellek nagyon sokat tanítottak nekünk arról, hogyan H. pylori megváltoztatja a gazdasejt jelátviteli útvonalát, a rendelkezésre álló gyomorsejtvonalak egyike sem szerveződik polarizált epitheliává. Alkalmazása H. pylori a polarizált Madin-Darby kutya vese (MDCK) sejtek új aspektusait tárták fel H. pylori biológia, beleértve a sejteken belüli vakuolákban való létezésének képességét (Amieva et al., 2002) és hatása a sejtcsomópontokra (Amieva et al., 2003). Ezenkívül a H. pylori a tenyésztett immunsejtekkel való kölcsönhatások szintén újat tártak fel H. pylori immunmoduláló hatások (áttekintve: Monack et al., 2004). A sejttenyészet azonban nem képes összefoglalni a gyomorban található több sejttípus komplex kölcsönhatását.
Egy másik nagy kihívás a H. pylori A különböző laboratóriumok által használt törzsek sokfélesége megnehezítette az eredmények általánosítását. Természetes izolátumok H. pylori genomtartalmukban 20% -nál nagyobb mértékben különbözhetnek (Salama et al., 2000). Egyetlen törzs is gyorsan laboratóriumi alkalmazkodást szenved; például a 26695 törzs, amelynek genomszekvenciáját először határozták meg (Tomb et al., 1997) megállapították, hogy a labor áthaladása után elvesztette a virulencia tulajdonságait (például a mozgékonyságot és a CagA-bejuttatást) (Fischer et al., 2001; Hoffman et al., 2003). A második törzs, amelynél a szekvenciát meghatározták, a J99, egy nemrégiben végzett klinikai izolátum egy fekélybetegtől, amelyet úgy választottak meg, hogy elkerüljék a laboratóriumi passzázs által bevezetett genomváltozásokat (Alm et al., 1999). Míg az összehasonlító szekvenciaelemzés informatív volt, a J99-nek kiderült, hogy a fontos virulencia-determináns CagA kevésbé virulens, nem foszforilálható formája van, és ezért nem használható a H. pylori.
A IV. Típusú szekréciós rendszerek felfedik titkaikat
Az elmúlt évek izgalmas új betekintést nyújtottak a TFSS-ek mechanizmusaiba, amelyek számos baktérium-kórokozóban és szimbiontusban megtalálhatók, és evolúciós kapcsolatban állnak a baktériumok konjugációs rendszereivel (Cascales és Christie, 2003). A legjobban tanulmányozott modell a TFSS Agrobacterium tumefaciens, egy szekréciós rendszer, amelyet ez az elcsépelt növényi kórokozó használ, hogy DNS-t és fehérjéket juttasson a növényi sejtekbe egy olyan folyamat során, amely bakteriális DNS-t vezet be a növény genomjába és daganatképződést okoz. DNS keresztkötéses és immunprecipitációs assay-t, specifikus mutánsokkal és antitestekkel kombinálva a fehérje-komponensekre Christie és munkatársai meg tudták határozni a szekréciós készüléken keresztül szállított DNS pontos pályáját. A szekréciós készülék funkcionális fehérje térképét, amely ezekből a vizsgálatokból származik, alátámasztják a fehérje – fehérje interakciós vizsgálatok és az immunhisztokémia (áttekintve Christie, 2004).
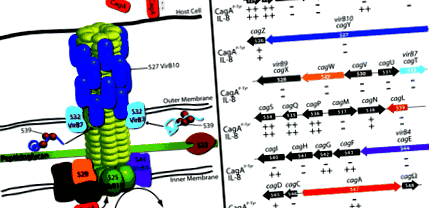
Hipotetikus cag A PAI TFSS az 1. ábrán látható H. pylori a konzervált TFSS komponensek közé tartoznak a belső membránon lokalizált VirB4 (HP0544/CagE) és VirB11 (HP0525) ATPázok, amelyek energiát szolgáltatnak a szubsztrát transzlokációjához. A cag A PAI a VirD4 (HP0524) kapcsoló fehérje homológját is kódolja, amely a A. tumefaciens és a konjugációs rendszerekről úgy gondolják, hogy a TFSS szubsztrátumokat juttatják el a szekréciós gépbe. Ban ben H. pylori A VirD4/HP0524 szükséges a CagA transzlokációhoz, de nem adagolható IL-8 indukcióhoz (Fischer et al., 2001; Selbach et al., 2002a).
A cag PAI TFSS. A. A hipotetikus konfigurációja cag PAI TFSS alapján A. tumefaciens és elektronmikroszkópia. B. A grafikus ábrázolása cag PAI innen: H. pylori a 26695 törzs, amely relatív génméretet és orientációt mutat. Az izogén mutánsok CagA-bejuttatását és IL-8 indukciós fenotípusát az egyes gének alatt összegezzük, Fischer-től et al. (2001).
Csak szekvenciával, H. pylori úgy tűnik, hogy hiányzik a VirB8; azonban a topológiai elemzés azt sugallja, hogy a HP0530 hasonlóan működhet, mint ez a belső membránhoz kötött fehérje (Buhrdorf et al., 2003). Hasonlóképpen javasolták a HP0529 működését, mint a VirB6, a mutáns fenotípus és öt vagy hat előre jelzett transzmembrán hélix jelenléte alapján. Egy végső gén azt javasolja, hogy működjön, mint egy A. tumefaciens A vir gén a HP0523, amely a VirB1-hez hasonlóan transzglikozilázról van szó, amely lebontja a peptidoglikán réteget, megkönnyítve a TFSS összegyűjtését a baktérium sejtfalon (Rohde et al., 2003). A HP0523 nem képes kiegészíteni egy A. tumefaciens virB1 mutáns (Hoppner et al., 2004), de szükséges a pilusszal társult HP0527/VirB10 és HP0532/VirB7 érleléséhez, csakúgy, mint a HP0539, ezeknek a fehérjéknek a feltételezett kísérője (Rohde et al., 2003).
Helicobacter pylori TFSS szubsztrát: CagA
Ezektől a rendszerektől eltérően a cag A mai napig azonosított PAI TFSS a CagA (Segal et al., 1999; Asahi et al., 2000; Backert et al., 2000; Odenbreit et al., 2000; Kőedénykorsó et al., 2000). A CagA hámsejtekben végzett sejtes aktivitásának vizsgálata azt mutatja, hogy a CagA nagyszámú gazdafehérjével lép kölcsönhatásba, és többszörös hatást gyakorol a gazdaszignál transzdukciós útvonalaira, a citoszkelonra és a sejtcsomópontokra (2. ábra).
A CagA sejtes aktivitása. (1) A CagA-t egy IV típusú szekréciós rendszeren keresztül juttatják a gazdasejtekbe. (2) A CagA a szűk kereszteződésű JAM és ZO-1 fehérjékkel társul, függetlenül annak tirozin-foszforilációs állapotától. (3) c-Src tirozin foszforilálja a CagA-t az EPIYA helyeken. (4) Negatív visszacsatolási ciklusban a CagA P-Tyr közvetlenül és a Csk aktiválásával gátolja a c-Src-t. (5) A c-Src gátlása a kortaktin és az ezrin defoszforilezéséhez vezet, ami hozzájárulhat a sejt morfológiai változásaihoz és motilitásához. (6) A CagA P-Tyr társul és aktiválja az SHP-2-t az SH2 doménekkel való interakció révén. (7) A CagA asszociál a bazolaterális sejtfelszínen elhelyezkedő c-Met receptorral és a PLCγ-val. (8) Az SHP ‐ 2 stimulálja az ERK kináz hosszan tartó aktivitását. Az SHP ‐ 2, c ‐ Met aktiválása. A PLCγ és az ERK mind szükséges a CagA-indukálta sejt megnyúláshoz és mozgékonysághoz.
A gazdasejtbe juttatva a CagA a sejtmembránon lokalizálódik a baktériumok kapcsolódási pontja alatt (Segal et al., 1999; Tanaka et al., 2003) és kolokalizálódik a ZO ‐ 1 és JAM fehérjékkel, amelyek általában a sejtek találkozásánál találhatók meg (Amieva et al., 2003). A CagA-t szubsztrátként ismerik el az Src-kinázok, amelyek egyedi C-terminális régiójú EPIYA-motívumok tirozin-maradékain foszforilálják (Selbach et al., 2002b; Kőedénykorsó et al., 2002). A junction fehérjék újraelosztása a CagA foszforilációjától függetlenül történik, és elősegíti a szűk kereszteződések szivárgását (Amieva et al., 2003), míg más sejtszintű változásokat, beleértve a sejtek megnyúlását, a CagA foszforilezett formája közvetíti. Továbbá H. pylori a fertőzés kiváltja az AGS-sejtek mozgékonyságát, más néven sejtszóródást. Míg a motoros válasz egyik alkotóeleme független a CagA-tól (Churin et al., 2003), a foszforilezett CagA expressziója elegendő az AGS sejt szétszóródásának kiváltásához, és szorosan korrelál a sejt megnyúlási fenotípusával (Higashi et al., 2004).
A foszforilezett CagA számos gazdafehérjével lép kölcsönhatásba. Ezen interakciók közül a legjobban a tirozin-foszfatázt, az SHP ‐ 2-et tartalmazó Src-homology 2 (SH2) doménnel (Higashi et al., 2002a). Az SHP ‐ 2 a receptor tirozin kinázok (RTK), például a hepatocita növekedési faktor/scatter faktor c-Met receptor transzduktora, amely elősegíti a sejtek mozgékonyságát és szaporodását (áttekintve: Neel et al., 2003). Az SHP-2 aktiválódik a tirozin-foszforilált szubsztrátokkal való kölcsönhatás révén a két SH2 doménjén keresztül, ami konformációs változást okoz a foszfatáz domént kitevő molekulában. Alatt H. pylori az AGS sejtek fertőzése esetén az SHP ‐ 2 felvételre kerül a sejtmembránba, és CagA-függő módon aktiválódik (Higashi et al., 2002a). Az SHP ‐ 2 – CagA komplexeket is együtt immunprecipitálták a gyomor biopsziás szövetéből (Yamazaki et al., 2003) bemutatja ennek az interakciónak a relevanciáját in vivo. Tudjuk, hogy a CagA sejtnyúltság-indukcióját az SHP-2 közvetíti, mert az siRNS által az SHP-2 kimerülése blokkolja a kolibri fenotípust (Higashi et al., 2004; Higuchi et al., 2004). Ezenkívül az SHP ‐ 2 aktiválása elegendő a sejt megnyúlásának kiváltására, amint azt az SHP ‐ 2 membránra célzott változata bizonyítja (Higashi et al., 2002a). A sejt megnyúlása szempontjából fontos SHP ‐ 2 aktiváció egyik következménye az extracelluláris szignál által szabályozott kináz (ERK) tartós stimulálása (Churin et al., 2003; Higashi et al., 2004).
Az SHP-2-vel való kölcsönhatása mellett a CagA kimutatták, hogy kölcsönhatásba lép az RTK jelátviteli utak más komponenseivel is. Ide tartozik az RTK c-Met és annak effektora, a PLCγ, egy foszfolipáz, amelynek PIP2 terméke aktiválja a gelsolint, a profilint és a cofilint, ami az aktin dinamikájának változásához vezet (Churin et al., 2003). Beszámoltak arról, hogy a CagA kölcsönhatásba lép a Grb2 RTK adapter molekulával (Mimuro et al., 2002), bár mások nem tudták reprodukálni ezt az utóbbi interakciót (Higashi et al., 2004). A fehérje-interakciók ezen hálózata alapján a CagA-t javasolták a Gab dokkoló/állványozó adapter fehérje utánzójaként, amely az SHP-2-t toborozza a membránhoz, aktiválva az RTK-jelátviteli komponenseket (Hatakeyama, 2003). Egy ilyen modellben kulcsfontosságú különbség Gab és CagA között az, hogy míg Gab-et az RTK aktiválása szabályozza, a foszforilezett CagA az SHP-2 folyamatos aktiválásával konstitutív c-Met stimuláció állapotát hozza létre. A foszforilezett CagA nem teljesen szabályozatlan, mivel úgy tűnik, hogy negatív visszacsatolási hurokban inaktiválja kinázát, a c-Src-t. Erről beszámoltak, hogy a foszforilezett CagA és a c-Src (Selbach et al., 2003), valamint a C-terminális Src kináz (Csk) CagA-kötésével és aktiválásával, amely ezután tirozin foszforilálja és inaktiválja az Src család kinázait (Tsutsumi et al., 2003).
A CagA Src kinázainak inaktiválása nemcsak a CagA aktivitásának korlátozásában fontos, hanem más AGS sejtfehérjék, például ezrin és kortaxin (Selbach) defoszforilezését is eredményezi et al., 2003; 2004), amely elősegítheti a sejtek megnyúlását. Az ezrin és a cortactin egyaránt modulálja az aktin szerveződést, és kimutatták, hogy szabályozzák az aktin dinamikáját a sejtekkel való érintkezés során kórokozókkal, beleértve az enteropatogéneket is. Escherichia coli, Salmonella és Cryptosporidium (Daly, 2004). A kortaktin megköti az F-aktint és az Arp2/3-at, és nem tirozin-foszforilezett formájában növeli az aktin keresztkötési képességét, ami fontos lehet az aktinkötegek stabilizálásához a CagA-indukálta sejtnyúlásban. Ezrin az ERM (ezrin-radixin-moesin) fehérjecsalád tagja, és speciális membránterületeken található meg, például mikrovillusokban, ahol az F-aktint összeköti a membránfehérjékkel (Bretscher et al., 2002). Míg a treonin-foszforilációról kimutatták, hogy aktiválja az ezrint, az ezrin Src által végzett tirozin-foszforilációjának és az azt követő Sf-inaktiválás utáni defoszforilezésének következményei rosszul ismertek.
Az eukarióta sejtekben nemcsak a CagA foszforilezésére van szükség aktivitásának nagy részéhez, hanem a CagA-n belüli foszforilációs helyek jelenléte, típusa és száma is figyelembe veheti a virulencia törzsbeli különbségeit. A motívumokat A, B, C vagy D kategóriába sorolták, az A és B motívumok szinte minden klinikai esetben jelen voltak cagA+ izolátumok, míg a C és D motívumok törzsspecifikusak (Higashi et al., 2002b). A C motívum a nyugati országok izolátumaiban található, és ezt Western CagA-specifikus szekvenciának nevezik. A keleti izolátumok nem tartalmazzák a C motívumot; ehelyett kelet-ázsiai CagA-specifikus szekvenciájuk van, más néven EPIYA-D. Az EPIYA motívumok száma és típusa pozitívan korrelál a foszforilezett CagA mennyiségével a sejtben és az SHP ‐ 2 aktiválásának képességével (Higashi et al., 2002b). Ezenkívül a CagA SHP ‐ 2-aktivációjának potenciálja pozitívan korrelál a gyomorrák kialakulásával (Azuma et al., 2004).
A CagA-független hatásai cag PAI
Következtetések
Azonnali tanulmányok a H. pylori–Gazdaház-kölcsönhatások képesek legyenek megválaszolni a következő kérdéseket:
i. Vannak - e a fehérje szubsztrátjai a cag A PAI TFSS, kivéve a CagA-t, és mi a TFSS szekréciós jel? Olyan fúziós fehérje stratégiák alkalmazhatók, amelyek sikeresen azonosították a TFSS szubsztrátumokat más rendszerekben H. pylori.
(ii) A CagA úgy működik, mint egy állvány adapterfehérje az eukarióta sejtekben, és milyen gazdaproteinekre van szükség a jelátviteléhez? Különösen milyen SHP ‐ 2 szubsztrátokra van szükség a CagA gazdasejtekre gyakorolt hatásához?
(iii) Hogyan kerül a peptidoglikán a gazdasejt citoplazmájába? Szükség van-e a transzferre a TFSS pilusra? Gazdasejt endocitózis? Membránfúzió?
Csak azáltal, hogy feltárjuk a mechanizmus részleteit a kölcsönhatás között H. pylori és eukarióta sejtek megpróbálhatjuk-e megérteni, hogyan játszódnak le ezek a sejtes kölcsönhatások szöveti és organizmi szinten a baktériumok és a gazdaszervezetek egész életen át tartó együttélése során.
- Helicobacter Pylori Johns Hopkins orvostudomány
- Helicobacter pylori (H
- Helicobacter pylori, mi ez és hogyan kell kezelni
- A Helicobacter pylori fertőzés súlyosbítja a bél mikrobiomjának diszbiózisát gyomorhurutban szenvedő gyermekeknél
- Az étkezés szabálytalan időzítése összefügg a Helicobacter pylori fertőzéssel és a gyomorhurut