JOP. A hasnyálmirigy folyóirata
Marlon E. Cerf * és Johan Louw
Dél-afrikai Orvosi Kutatási Tanács, Fokváros, Dél-Afrika
* Levelező szerző: Marlon E Cerf
Diabetes Discovery Platform
Dél-afrikai Orvosi Kutatási Tanács
P. O. Box 19070; Tygerberg
7505, Fokváros; Dél-Afrika
Tel +27–21. 938. 0304
Fax +27- 21. 938. 0456
Email marlon. [e-mail védett] ac. za
Megkapta 2013. április 16. Elfogadott 2014. március 3
Absztrakt
Kulcsszavak
Sejtproliferáció; Diabetes Mellitus, 2. típus; Glükagont szekretáló sejtek; Hyperlipidemia; Inzulinszekretáló sejtek; Langerhans-szigetek
Rövidítések
ANOVA: varianciaanalízis; FFA: szabad zsírsav; GSIS: glükóz-stimulált inzulin szekréció; HF: magas zsírtartalmú; HFD: magas zsírtartalmú étrend; HOMA-B: homeosztázis modell értékelése béta sejt funkció; HOMA-IR: homeosztázis modell értékelése inzulinrezisztencia
BEVEZETÉS
A szigetsejtek az egész életen át fejlődnek, és a glükóz homeosztázis fenntartása érdekében az anyagcsere igényére reagálva plaszticitást mutatnak. Egerekben a hasnyálmirigy rügye a
e9. Ábra az elsődleges átmenet során olyan sejteket tartalmaz, amelyek a felnőtt hasnyálmirigy mindhárom fő vonalát előidézhetik: endokrin, exokrin és csatorna [1]. A mesenchyme szükséges az embrionális hasnyálmirigy helyes mintázatához, növekedéséhez és differenciálódásához [2]. A rágcsálókban a legtöbb sziget a születés előtt és a születést követő közvetlen időszakban fejlődik ki, miközben jelentős átalakításon megy keresztül. A rágcsálók szigeti fejlődésének kritikus periódusai a szigetek morfogenezise az e17–19-nél [3] és az élet első hete, amikor a neogenezis bekövetkezik [4]. A szigeti sejtek környezetében bekövetkező bármilyen zavar egy adott fejlődési időpontban megzavarhatja a kontroll faktorok egyensúlyát, hozzájárulva ezzel a béta sejtek diszfunkciójához és a cukorbetegséghez az élet későbbi szakaszaiban [5].
A megnövekedett inzulinigény megváltozott metabolikus állapota, mint például az elhízás, amely szorosan összefügg az inzulinrezisztenciával, érzékenységet kölcsönöz a metabolikus betegség kialakulásának. A magas zsírtartalmú (HF) táplálkozás az elhízás, az inzulinrezisztencia és a béta-sejtek diszfunkciójának patogenezisével jár. A magas zsírtartalmú étrendből (HFD) a megnövekedett szabad zsírsav (FFA) vagy telített zsírsav beáramlás adipogenezist és metabolikus szindrómát indukálhat, szintén modulálva a gyulladásos választ [2, 3]. A krónikus HFD-ken szenvedő rágcsálók elhízottak, hiperlipidémiásak, glükóz-intoleránsak és inzulin-érzéketlenek voltak az inzulinrezisztenciát tükröző károsodott inzulinjelzéssel [6]. Egy másik vizsgálatban a krónikus HFD-vel táplált egereknél az inzulinrezisztencia következtében béta-sejtek diszfunkciója, károsodott glükózstimulált inzulinszekréció (GSIS) és glükóz-intolerancia mutatkozott [7].
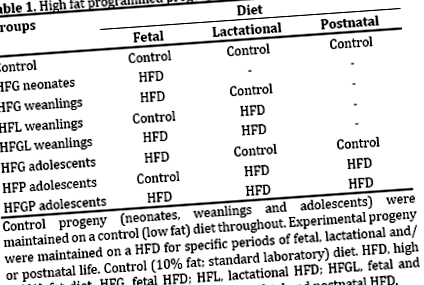
A programozás az ingereknek vagy sértéseknek (azaz eseményeknek) való kitettség a kritikus életszakaszokban, különösen a magzati és a laktációs élet során, amelyek az utódok anyagcseréjét és fiziológiáját azonnal, átmenetileg és/vagy tartósan alakítják. A magas telített zsír programozás (a továbbiakban HF programozás) a HFD-nek való kitettség (főként a telített zsír energiájának ≥40% -a) a kritikus életszakaszokban. Korábban kimutattuk, hogy a HF programozása megváltoztatta a szigeti sejtek fejlődését és fiziológiáját, különösképpen veszélyeztetve a béta sejtek integritását és működését újszülött [8, 9], elválasztott [10, 11, 12] és serdülő patkányokban [13].
Nemrégiben a serdülő patkányokon végzett vizsgálatunk [13] azonban a nemekre jellemző hatásokra összpontosított, és nem a kombinált nemek globális reprezentatív hatásaira összpontosított, mint a korábbi újszülött- és elválasztási vizsgálatokban. Ezért a jelen tanulmány a serdülőkori utódok HF programozására adott szigetek válaszait értékeli (kombinált nemi fenotípusok). Bemutatjuk ezen serdülő utódok metabolikus paramétereinek (testtömeg, leptinemia, glikémia, inzulinémia, HOMA és lipidémia) és szigetecske morfometriájának (szigetsejtek száma, mérete, térfogata, arányai és proliferációja) változását.
ANYAGOK ÉS METÓDUSOK
Kísérleti terv
Metabolikus paraméterek
A vizsgált metabolikus paraméterek a testtömeg (korábban újszülötteknél és elválasztottaknál voltak meghatározva), a hasnyálmirigy súlya (szintén testtömeghez igazítva: hasnyálmirigy-súly/testtömeg X 100), az éhomi szérum leptin (patkányleptin RIA készlet, Linco Research, St. Charles, MO, USA; újszülötteknél az elégtelen szérummennyiség miatt nincs meghatározva), a vércukorszint (glükométer, Precision QID, MediSense, Oxfordshire, Egyesült Királyság) és a szérum inzulin koncentrációja (patkány inzulin RIA készlet, Linco Research; korábban újszülötteknél és elválasztottaknál határozták meg), HOMA-inzulinrezisztencia (IR) ([éhomi vércukorszint (mmol/L) X éhomi éhomi szérum inzulin (mU/L)]/22, 5)) és HOMA-béta sejtfunkció (B) ([20 X éhomi inzulin (mU)/L)]/glükóz (mmol/L) - 3, 5)). A HOMA indexeket adaptáltuk újszülöttek számára, mivel a szérumokat egyesítettük az inzulin mérésére; ezért nem álltak rendelkezésre egyedi inzulinkoncentrációk. A becsléshez azonban az inzulint a csoportonkénti glükózkoncentrációhoz illesztettük. Serdülőknél (újszülötteknél vagy elválasztottaknál nincs meghatározva) az éhomi szérum trigliceridet (GPO-PAP módszer, autohumalyzer A5, Human Diagnostics, Wiesbaden, Németország), az összes LDL- és HDL-koleszterint (gyors vékonyréteg-kromatográfiai-gáz-folyadék eljárás). meghatároztuk a korábban leírtak szerint [14]. Ezenkívül meghatároztuk az összes koleszterin és a HDL koleszterin arányát.
Testtömeg esetén n = 44 kontroll esetén, n = 9 HFG esetén, n = 20 HFP esetén és n = 10 HFGP serdülőknél. Hasnyálmirigy-súly esetén n = 6 a kontrollnál és n = 18 a HFG újszülötteknél; n = 14 a kontrollnál és n = 6 a HFG, HFL és HFGL elválasztásoknál; n = 40 a kontrollnál, n = 3 a HFG-nél, n = 6 a HFP-nél és n = 4 a HFGP serdülőknél. A leptin esetében n = 8 a kontrollhoz, n = 5 a HFG-hez, n = 8 a HFL-hez és n = 6 a HFGL-elválasztásokhoz; n = 16 a kontrollnál, n = 6 a HFG-nél, n = 14 a HFP-nél és n = 5 a HFGP serdülőknél. A glükózkoncentrációk esetében n = 46 a kontrollnál, n = 13 a HFG-nél, n = 24 a HFP-nél és n = 10 a HFGP serdülőknél. Inzulinkoncentrációk esetén n = 34 a kontroll, n = 8 a HFG esetében, n = 20 a HFP és n = 5 a HFGP serdülők esetében. HOMA-IR és HOMA-B esetén n = 10 a kontrollhoz és n = 6 a HFG újszülötteknél; n = 25 a kontrollnál, n = 6 a HFG esetében, n = 9 a HFL esetében és n = 5 a HFGL elválasztásoknál; n = 22 kontroll esetén, n = 7 HFG esetében, n = 14 HFP esetén (HOMA-IR esetében, de n = 13 HOMA-B esetén) és n = 5 HFGP serdülőknél. A lipidprofilok esetében n = 6 a kontroll és a HFG serdülőknél és n = 4 a HFGP esetében, míg a HFP serdülőket kizárták az n = 2 miatt.
Sziget morfometria
A Pancreata-t kétszer immunjelöltük inzulinnal és glükagonral, majd képelemzést végeztünk a korábban leírtak szerint [8]. Kiszámítottuk a béta és az alfa sejtek számát, méretét és térfogatát, a béta és az alfa sejt arányát (korábban újszülötteknél és HFG elválasztottaknál határozták meg), az alfa és a béta sejtek arányát, a szigetecske és az acináris sejtek proliferációs indexeit [8, 11, 13].
Az egész pancreatát 4 μm2 sorozatjelzéssel gyűjtöttük be immunjelölő kísérletekhez. Az alfa sejteket először poliklonális glükagon antitesttel (Dako, Carpinteria, CA, USA) immunjelöléssel láttuk el, majd a béta sejtek monoklonális inzulin antitesttel történő immunjelölését (Sigma ImmunoChemicals, St Louis, MO, USA) [13]. Képelemzéshez egy személyi számítógéphez rögzített Olympus BX60 fénymikroszkópra (Olympus, Tokió, Japán) szerelt Canon Powershot S40 digitális fényképezőgépet (Canon, Tochigi, Japán) használtak képek rögzítésére [13]. A végső digitalizált képek 768 x 1024 pixel méretűek voltak [13].
A sziget- és az acinarsejtek proliferációs indexeit a Ki67 (MIB5; DakoCytomation, Glostrup, Dánia) proliferációs markerrel végzett immunfestés után számítottuk ki [13]. Az egyes sejttípusokból (sziget- és acináris sejtek) ötszáz magot számláltunk [13]. A szigetek és az acináris sejtek proliferációjának meghatározásához a proliferatív sejtek számát elosztottuk a sejtek teljes számával [13]. Sziget- és acináris sejtproliferáció esetén n = 6 a kontroll és n = 12 a HFG újszülöttek esetében; n = 8 a kontrollnál, n = 6 a HFG és HFGL esetében, és n = 8 a HFL elválasztásoknál; n = 6 a kontrollnál és n = 5 a HFG, HFP és HFGP serdülőknél.
STATISZTIKA
Újszülöttek esetében a pár nélküli tanuló t tesztjét alkalmazták a két csoport elemzésére. Az elválasztott és serdülők esetében négy csoportot hasonlítottak össze egyirányú ANOVA alkalmazásával, amelyet Bonferroni post-hoc tesztje követett. Az adatokat átlag ± SEM-ként jelentjük, szignifikanciájával a p
- Hogyan lehet egy nagyobb fenékhez jutni nagy anyagcserével Egészségesen élni
- Élet Hypoproteinemia (alacsony fehérjetartalmú) magas fehérjetartalmú étrend Hypoproteinemia esetén - alacsony fehérjetartalom -
- Kipróbálta már valaki alacsony szénhidráttartalmú, magas fehérjetartalmú étrendet - BikeRadar
- Magas rosttartalmú étrendben, székletzel inkubált in vitro gáz-, metán- és szén-dioxid-termelés
- Horizon szerves, magas fehérjetartalmú teljes tej