Az étrend korlátozásának és az azt követő újrakészítésnek a hatása a szarvasmarha jejunal epithelium transzkripciós profiljára
Kate Keogh
1 Állat- és biotudományi osztály, Állat- és gyepkutatási és innovációs központ, Teagasc, Grange, Dunsany, Co. Meath, Írország
Sinead M. Waters
1 Állat- és biotudományi osztály, Állat- és gyepkutatási és innovációs központ, Teagasc, Grange, Dunsany, Co. Meath, Írország
Paul Cormican
1 Állat- és biotudomány-kutatási osztály, Állat- és gyepkutatási és innovációs központ, Teagasc, Grange, Dunsany, Co. Meath, Írország
Alan K. Kelly
2 Mezőgazdasági és Élelmiszeripari Iskola, University College Dublin, Belfield, Dublin 4, Írország
David A. Kenny
1 Állat- és biotudomány-kutatási osztály, Állat- és gyepkutatási és innovációs központ, Teagasc, Grange, Dunsany, Co. Meath, Írország
Társított adatok
Minden RNA-seq fájl elérhető az NCBI Gene Expression Omnibus adatbázisából (hozzáférési szám: GSE94004).
Absztrakt
Bevezetés
A gyomor-bél traktus alkotóelemeit tartalmazó szervekről ismételten kimutatták, hogy gyorsabb növekedést mutatnak az előzetes étrendi korlátozás utáni újrakészítéskor [3–6].
Anyagok és metódusok
A dublini Egyetemi Főiskola Állatkutatási Etikai Bizottsága jóváhagyta az összes eljárást állatok felhasználásával, és a jelenlegi vizsgálatot az Ír Egészségügyi és Gyermekminisztérium engedélyezte az Európai Közösség 86/609/EK irányelvével összhangban.
Állatkezelés
Szövetmintavétel
Valamennyi állatot emberségesen levágták egy EU engedéllyel rendelkező vágóhídon (Euro Farm Foods Ltd, Cooksgrove, Duleek, Co. Meath, Írország) fogságban történő kábító kábítással, majd kivéreztetéssel, és az összes szövetmintát levágás után összegyűjtötték. A jejunális szövetet (10 cm) körülbelül 30 cm-re gyűjtöttük a duodenal-jejunális csomóponttól távolabb. A mintákat összegyűjtöttük és Dulbecco-foszfáttal pufferolt fiziológiás sóoldatba (DPBS) helyeztük az esetleges digesta eltávolítása céljából. A jejunum szakaszokat eleinte DPBS-ben mossuk, majd a hosszanti tengely mentén elvágjuk, hogy a szövet lapos legyen. A szövet felnyitása után a jejunum epithelium mintákat másodszor mossuk DPBS-ben annak biztosítására, hogy ne maradjon digesta a szöveten. Ezután üvegmikroszkóp tárgylemez segítségével lehámozták a hámszövetet az alatta lévő kötő- és izomszövetről. A szövetet ezután egy gyűjtőcsőbe helyeztük, folyékony nitrogénben lefagyasztva, majd -80 ° C-on tároltuk.
RNS izolálás, szekvenálás és bioinformatikai elemzés
Az RNS-izolálást, a cDNS-könyvtár előkészítését és szekvenálását, valamint a bioinformatikai elemzést korábban már felvázoltuk [8, 9], és itt csak röviden ismertetjük. Körülbelül 30 mg fagyasztott jejunális hámból teljes RNS-t izoláltunk RNeasy Mini Kit (Qiagen, Egyesült Királyság) felhasználásával, a gyártó utasításainak megfelelően. Az RNS és az RNS integritásának mennyiségét egy Nanodrop spektrofotométer ND-1000 (Nanodrop Technologies, Wilmington, DE, USA, USA) és az RNA 6000 Nano Lab Chip kit (Agilent Technologies Ireland Ltd., Dublin, Írország) segítségével határoztuk meg. Csak a jó minőségű RNS-mintákat (RNS-integritásszám> 8) választottuk ki az ezt követő RNS-szekvenáláshoz (10 minta minden kezelési csoportból minden vágási időpontban). A cDNS-könyvtárakat 3 μg kiváló minőségű teljes RNS-ből készítettük az Illumina TruSeq RNS minta előkészítő készlet használatával, a gyártó utasításainak betartásával (Illumina, San Diego, CA, USA). Összesen 40 egyedi RNAseq könyvtárat multiplexeltünk a megfelelő mintadefektív adaptereik szerint, és 100 bázispár egyvégű szekvenálást hajtottunk végre 4 áramlási sávon egy Illumina HiSeq 2000 szekvenszeren.
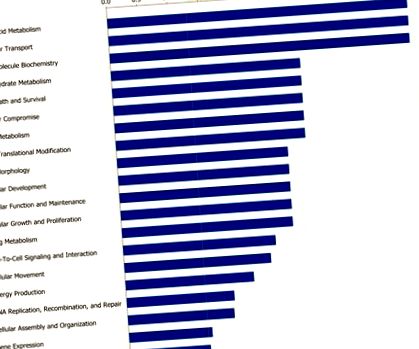
Útelemzés
A sávok jelzik annak valószínűségét [-log (P érték)], hogy az étrendi korlátozás befolyásolta a specifikus funkciót, összehasonlítva a differenciálisan expresszált gének listáján szereplő másokkal.
A sávok jelzik annak valószínűségét [-log (P érték)], hogy az étrendi korlátozás befolyásolta a specifikus funkciót, összehasonlítva a differenciálisan expresszált gének listáján szereplő másokkal.
Asztal 1
| ANPEP | Alanil (membrán) aminopeptidáz | -26.2 |
| ANXA10 | Annexin A10 | -4.4 |
| AP3B2 | Az adapterrel kapcsolatos fehérje-komplex 3, béta 2 alegység | -8.7 |
| ASIC3 | Savérzékelő (protonkapu) ioncsatorna 3 | -11.3 |
| ASNS | Aszparagin-szintetáz (glutamin-hidrolizáló) | 2.3 |
| AUTÓK | Ciszteinil-tRNS-szintetáz | 1.6 |
| CTSW | Cathepsin W | 1.9 |
| DAPL1 | Halálhoz kapcsolódó fehérjeszerű 1 | -6.7 |
| ELL3 | Nyúlási faktor RNS-polimeráz II-szerű 3 | -3.9 |
| INSIG1 | Az inzulin által indukált gén 1 | -1.9 |
| OLFML3 | Olfaktomedin-szerű 3 | 2.0 |
| PAPSS2 | 3'-foszfoadenozin-5'-foszfoszulfát-szintáz 2 | -3.5 |
| PGA3 | Pepszinogén-3 | -2.8 |
| S100A2 | S100 kalciumkötő fehérje A2 | -2.8 |
| SDS | Szerin-dehidratáz | -3.1 |
| SLC1A5 | 1. oldott hordozó család (semleges aminosav transzporter), 5. tag | 2.0 |
| SLC7A5 | Oldott hordozó 7. család (aminosav transzporter könnyű lánc, L rendszer), 5. tag | 2.1 |
| WNT2 | Szárny nélküli típusú MMTV integrációs hely családtagja 2 | 2.2 |
1 A korlátozottan etetett állatokban a hajtások változásai felfelé vagy lefelé mutatnak, az ad libitum táplált kontroll állatokhoz képest
2. táblázat
| ADIRF | Adipogenezis szabályozó tényező | -3.2 |
| ANXA10 | Annexin A10 | 3.9 |
| ASNS | Aszparagin-szintetáz (glutamin-hidrolizáló) | -2.4 |
| CMA1 | Kimáz 1, hízósejt | -3.1 |
| DAPL1 | Halálhoz kapcsolódó fehérjeszerű 1 | 6.6 |
| DDAH1 | Dimetilarginin-dimetilaminohidroláz | 2.3 |
| DNSH2 | Dynein, axonemal, nehézlánc 2 | 2.6 |
| EFR3B | EFR3 homológ B (S. cerevisiae) | 2.3 |
| GCNT3 | Glükózaminil (N-acetil) transzferáz 3, mucin típusú | 8.9 |
| GSTA1 | Alfa-glutation-S-transzferáz | 16.7 |
| HERPUD1 | Homocisztein által indukálható, endoplazmatikus retikulum stressz által indukálható, ubiquitin-szerű doméntag 1 | -1.7 |
| IL17RB | Interleukin 17 receptor B | -1.9 |
| INSIG1 | Az inzulin által indukált gén 1 | 2.4 |
| IRG1 | Immunrezonzív 1 homológ (egér) | 3.0 |
| LRRC17 | Gazdag leucin ismétlés, amely 17-et tartalmaz | -2.9 |
| LTC4S | Leukotrién C4 szintáz | -2.3 |
| LTF | Laktotranszferrin | 2.9 |
| MAP1LC3C | Mikrotubulusokhoz kapcsolódó fehérje 1 könnyű lánc 3 gamma | -2.9 |
| PFKFB3 | 6-foszfofrukto-2-kináz/fruktóz-2,6-bifoszfatáz 3 | 2.2 |
| PGA3 | Pepszinogén-3 | 4.9 |
| PLP1 | Proteolipid fehérje 1 | -2.8 |
| PRLR | Prolactin receptor | 2.1 |
| PSAT1 | Foszfozerin-aminotranszferáz 1 | -2.6 |
| S100A2 | S100 kalciumkötő fehérje A2 | 5.1 |
| SCG2 | Szekretogranin II | -3.2 |
| SDS | Szerin-dehidratáz | 4.8 |
| SDSL | Szerin-dehidratáz-szerű | 3.1 |
| SLAMF7 | SLAM családtag 7 | -1.9 |
| TFF2 | Trefoil faktor 2 | 18. |
| TNFRSF11B | A tumor nekrózis faktor receptor szupercsalád, 11b tag | 2.1 |
1 A hajtásváltozások a RES kezelési csoporton belül vannak a kompenzációs állatokban, a korlátozottan táplált állatokkal összehasonlítva.
Vita
Emésztés és anyagcsere
Az emésztési és anyagcsere-folyamatokban való funkcionalitása mellett a jejunum az emésztett tápanyagok felszívódásának elsődleges helye a bélfalon keresztül a májban történő felvételhez és további anyagcseréhez [30]. Az 1. periódus végén nyilvánvaló volt az oldott anyaghoz hasonló vivő aminosav transzportereket kódoló két gén, nevezetesen az SLC1A5 és az SLC7A5 szabályozása. A jejunumot korábban a vékonybélben azonosították az aminosav- és peptidfelszívódás fő helyeként [30, 31]. Az SLC1A5 és az SLC7A5 jelen tanulmányban megfigyelt nagyobb expressziója tükrözheti az aminosavak felvételének fokozott igényét és az étrendből származó tápanyagok nagyobb mértékű felhasználását az étrendi korlátozás során.
A jelenlegi tanulmányban az étrendi korlátozás időszaka társult az anyagcserében és az emésztésben részt vevő gének szabályozásával. Viszont fordítva, az újbóli kezelés során az anyagcserében és az emésztésben részt vevő DEG-ket később szabályozták. Például az anyagcserében részt vevő gének, köztük a PGA3, a PFKB3, az SDS és az SDSL, a CG-n átesett állatokban az étrendi korlátozás alatt megfigyelthez képest (RES 2. periódus a RES 1. periódushoz viszonyítva) felfelé voltak szabályozva. A PFKFB3 a glikolízisben részt vevő enzimet kódolja [32], míg az SDS és az SDSL egyaránt a szerin és a glicin metabolizmusában szerepet játszó géneket kódolja. Ezzel összhangban Connor és mtsai. [21] és Keogh és mtsai. [8] mindkettő megfigyelte az anyagcserében részt vevő gének nagyobb expresszióját az újbóli alimentáció során indukált CG-t a májszövetben. Az anyagcsere-gének nagyobb mértékű kifejeződése a 2. periódusban nagyobb táplálékbevitel mellett következett be azoknál az állatoknál, akik újraterheléssel indukált CG-t kaptak [6], ami valószínűleg nagyobb igényt mutatott az anyagcsere-folyamatok iránt, ha a jejunális hámban ez idő alatt nagyobb mennyiségű táplálék-bevitel történt. További vizsgálatokra van azonban szükség az anyagcsere-szervek metabolikus állapotának értékeléséhez mind az étrendi korlátozásra, mind a CG-re adott válaszként.
Sejtszaporodás és differenciálódás
Immunfunkció és sejtes méregtelenítés
Következtetések
- Az étrendi korlátozás és az azt követő újbóli kezelés hatása a transzkripciós profilra
- Az étrendi fehérjeszintek hatása a növekedési teljesítményre, a hematológiai profilra és a biokémiai tulajdonságokra
- Az étrendi kefir hatása a szőlő növekedési teljesítményére, takarmány-felhasználására és zsírsavprofiljára
- A Covid-19 és az azt követő lezárás a lakosság majdnem felének módosított táplálkozási szokásait
- Étrendi korlátozó magatartás és mértéktelen étkezés anorexia nervosa, bulimia nervosa és falatozás esetén