Anyai elhízás és az anyagcserezavarok fejlődési programozása utódokban: bizonyítékok állatmodellekből
1 Liggins Intézet és a Növekedés és Fejlődés Nemzeti Kutatóközpontja, Aucklandi Egyetem, Auckland 1142, Új-Zéland
Absztrakt
1.Háttér
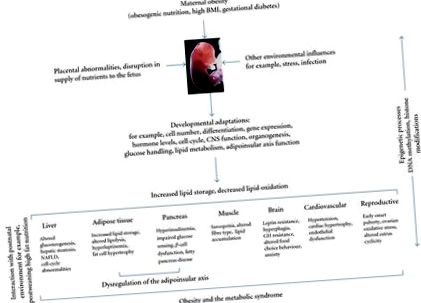
Az elhízás és a kapcsolódó anyagcserezavarok jelenlegi járványát a jólét tünetének tekintik, amelynek elsődleges oka az obezogén környezet kialakulása és a magas kalóriatartalmú ételekhez való hozzáférés megkönnyítése, valamint a munka- és szabadidős tevékenységek energiafogyasztásának csökkenése [1]. A metabolikus szindrómát a kardiovaszkuláris kockázati tényezők csoportosulása jellemzi, beleértve a cukorbetegséget, az elhízást, a hiperlipidémiát és a magas vérnyomást, és valószínűleg a gének, az étrendi bevitel, a fizikai aktivitás és a környezet közötti összetett kölcsönhatások eredménye. A metabolikus szindróma kockázati tulajdonságainak csoportjában az inzulinrezisztenciát és a zsigeri elhízást ismerték el a legfontosabb ok-okozati tényezőként [2]. Számos olyan gént azonosítottak, amelyek emberi elhízással és metabolikus szindrómával társulnak [1, 3], de ennek az állapotnak a genetikai összetevője nem számolhat az elhízás és a metabolikus szindróma prevalenciájának az utóbbi években bekövetkezett jelentős növekedésével. Ebben az összefüggésben az egészség és a betegség (DOHaD) hipotézise fejlesztési eredete rávilágított az összefüggésre a perikonceptuális, a magzati és a korai csecsemő életszakaszai, valamint a felnőttkori elhízás későbbi kialakulása és a metabolikus szindróma között [4–6].
A fejlesztési programozási keretet megalapozó mechanizmusok, valamint a genetikai és környezeti tényezők szerepe továbbra is spekulatív. Az egyik általános tézis az, hogy a kedvezőtlen méhen belüli környezetre reagálva a magzat adaptálja fiziológiai fejlődését, hogy maximalizálja közvetlen túlélési esélyeit. Ezek az adaptációk magukban foglalhatják a metabolikus homeosztázis alapértékeinek, az endokrin rendszereknek a visszaállítását és a növekedés visszaszabályozását, amelyek általában megváltozott születési fenotípusban nyilvánulnak meg. Újabban a „prediktív adaptív válasz” (PAR) hipotézis azt javasolja, hogy a pre- és postnatális környezetek közötti eltérés mértéke a későbbi betegségkockázat fő meghatározója [7, 8]. Tehát úgy gondolják, hogy bár a magzati fiziológia adaptív változásai hasznosak lehetnek a rövid távú túlélés szempontjából a méhben, későbbi életkorukban rosszul alkalmazkodhatnak, hozzájárulva a káros egészségügyi eredményekhez, amikor az utódokat felzárkózási növekedés, étrend okozta elhízás és egyéb tényezők érik [8, 9].
2. Az anyai elhízás állatmodelljei
2.1. Rágcsáló modellek
A rágcsáló a leggyakrabban használt modellfaj a fejlődési programozás vizsgálatához az anyai obesogén táplálkozási környezeten keresztül. Az anyai büfé vagy a magas zsírtartalmú étrend kimutatták, hogy elhízást, inzulin- és leptinrezisztenciát [15–17], magas vérnyomást [18–21], zsíros hasnyálmirigy-betegséget [22], máj steatózist és alkoholmentes zsírmájbetegséget vált ki. utódokban [23–26] (1. ábra). Azt is beszámolták, hogy az anya zsírosodása, és nem az étkezési zsír önmagában, hiperleptinémiát és inzulinrezisztenciát indukál az utódokban, valamint megnövekedett testtömeg, amely felnőttkorban is fennáll [27]. Kimutatták, hogy még az anya túlzott táplálkozása is fokozott zsírbetegséget, glükóz-intoleranciát és megváltozott agyi étvágyszabályozókat okoz az utódokban [28]. Saját korábbi munkánk kimutatta, hogy a mérsékelt anyai HF-diéta szignifikáns elhízást és hiperinsulinémiát eredményez férfi és női utódokban, függetlenül a prekoncepcionális elhízás szintjétől [29] (2. ábra).
2.2. Juh modellek
A juhmodelleket kevésbé tanulmányozzák, mint a rágcsálókat, de a juhmodellekből erős bizonyíték áll rendelkezésre arra vonatkozóan, hogy az anyák elhízása hajlamos az utódok növekedésének megváltozására és metabolikus következményeire, amelyek szorosan párhuzamosak a kis állatmodellekkel megfigyelt adatokkal. Zhang és munkatársai tanulmányában az anyák elhízásának juhmodelljét alkalmazták, amelyben az anyajuhokat túltáplálták annak érdekében, hogy elhízást idézzenek elő fogantatáskor és a terhesség alatt. A terhesség közepén az elhízott anyajuhok magzata makroszóma, hiperglikémiás és hiperinsulinémiás volt, és a hasnyálmirigy súlya jelentősen megnőtt, β-sejtszámok összehasonlítva a szükséglet szerint táplált anyajuhok magzatával. Ezek az adatok azt is kimutatták, hogy az anyák elhízása a magzat hasnyálmirigyének növekedésére és β-sejtszám a korai és késői vemhesség alatt. A terhesség első felében a hasnyálmirigy növekedése jelentősen megnőtt, β-sejtproliferáció és inzulin szekréció, majd a hasnyálmirigy növekedésének csökkenése és β-sejtszám a késői terhességben, ami a keringő inzulin csökkenését eredményezi [38].
Az anyák elhízása és a megnövekedett tápanyagbevitel az anyajuhban a terhesség előtt és alatt változó növekedést, zsírosodást és glükóztoleranciát eredményez a felnőtt utódokban [39]. A rágcsáló vizsgálatokhoz hasonlóan a terhesség alatti túlzott táplálkozás és súlygyarapodás különböző szintjei eltérő hatással vannak a magzat növekedésére és a szervek fejlődésére [40]. Az anyák túlzott tápláltsága a késői terhességben a PPAR felülszabályozását eredményeziγ-aktivált gének a magzati zsigeri zsírban, majd a szubkután zsír tömegének növekedése a posztnatális bárányban. Az anyák túlzott táplálkozásának való kitettség önmagában a perikoncepcionális periódus alatt azonban csak a nőstény bárányok testzsír-tömegének növekedését eredményezte, domináns hatást gyakorolva a zsigeri zsírraktárakra. Ezért azt javasolták, hogy a későbbi elhízás korai programozása „két találatból” származhat, amelyek közül az első az anyai túl táplálkozás következtében jelentkezik a perikoncepcionális időszakban, a második pedig a késői terhesség fokozott magzati táplálkozásának eredményeként [40].
Ellentétben a rágcsálókkal foglalkozó irodalommal, ahol az anyák elhízása kimutatták, hogy az újszülött leptinje felerősödött és elhúzódó [49], a juhok adatai azt mutatták, hogy az anyák elhízása megszünteti az újszülött bárány plazma leptin csúcsát [39]. Ezek a különbségek a patkány születéskori, a bárányhoz viszonyított viszonylagos éretlenségével magyarázhatók, az újszülött bárány az emberrel egyenértékűbb érettségi szinten született [39].
2.3. Nem emberi prímás
A japán makákóban HF diéta fogyasztása, függetlenül az anyák elhízásától, fokozott placenta gyulladásos citokinek és a Toll-szerű receptor 4 expressziója [47]. A HF diéta fogyasztása csökkentette a véráramlást a placenta magzati oldalán, és jelentősen megnövelte a placenta infarktusok és a halva születés gyakoriságát. Ezek az eredmények arra utalnak, hogy az elhízástól független HF-diéta csökkenti a méh térfogatú véráramlást, az anyai elhízással és az inzulinrezisztenciával tovább súlyosbítva a placenta diszfunkcióját, és megnövelve a halva születés gyakoriságát [47]. Ez összhangban áll a rágcsálók adataival, amelyek alapján az anyai HF-diéta kimutatta, hogy csökkent magzati és placenta-junkcionális zóna súlyát eredményezi [48].
3. Mechanizmusok
Az anyák elhízásának alapját képező mechanizmusok és az utódok elhízási kockázatának programozása nincsenek pontosan meghatározva. A mai napig korlátozott mennyiségű adat rávilágít a megváltozott leptin termelés és szabályozás szerepére, valamint az étvágyszabályozásban és az energiaegyensúlyban részt vevő legfontosabb gének hipotalamusz-szabályozásában bekövetkezett változásokra. Bizonyíték van a vázizom-anyagcsere megváltozására és az anyai HF-diéta által kiváltott hatásokra a placenta szerkezetére és működésére.
3.1. A leptin és az energiaegyensúly szabályozása
3.2. Hipotalamusz újraprogramozása
Annak ellenére, hogy egyre növekszik a leptin rágcsálókban bekövetkező neurotróp szerepe, az emberekben betöltött potenciális szerep és az esetleges leptin-túlfeszültség időzítése kevésbé meghatározott. Kirk és mtsai. kimutatták, hogy az anyai étrend által kiváltott elhízás a leptinrezisztencia programozásával és az ívelt magot és a paraventricularis magot érintő megváltozott hipotalamusz funkciókkal véglegesen befolyásolja az utódok táplálékfelvételét szabályozó központi folyamatokat. Ezenkívül az intrauterin és a korai posztnatális túl táplálkozás programja az elválasztás utódainál az étvágystimulátor Y neuropeptidet (NPY) és a szuppresszor proopiomelanokortint (POMC) kifejező hipotalamusz neuronok [15]. Az ilyen programozás hosszú távú hatásai és kölcsönhatásai az elválasztás utáni HF étrend fogyasztásával azonban továbbra sem tisztázottak. Számos tanulmány rávilágított az elhízott anyák utódainál a peroxiszóma proliferátor által aktivált receptor (PPAR) génexpresszió változásaira, amelyek hozzájárulhatnak a zavart lipid homeosztázishoz. A HF utódoknak csökkent a máj PPAR értékeγ expresszió összehasonlítva a kontrollokkal és a csökkent máj máj PPAR-valα expresszió, amely negatívan korrelált a szérum triglicerid szintjével [57].
3.3. Csontvázizom- és mozgásszervi aktivitás
Simar és munkatársai munkája. felnőtt patkányoknál kölcsönhatás mutatkozott az anyai elhízás és a posztnatális túl táplálkozás között a vázizom anyagcseréjében. A választás utáni HF étrend additív hatást fejtett ki az anya elhízásával szemben a testtömegre és a vázizom markereire a glükóz és a lipid anyagcsere vonatkozásában, de nem a plazma glükózra és inzulinra. szintek, ami arra utal, hogy az anya elhízása és a posztnatális túlzott táplálkozás különböző mechanizmusok révén rontja a vázizomzat működését [58]. Csökkent izomtömegről számoltak be elhízott egerek 3- és 6 hónapos hím és nőstény utódainál is [31], és csökkentette az izomerőt az egészségtelen táplálékkal táplált anyák utódainál [59]. A juhokon végzett munka szorosan megfelel a patkánynak; Az elhízott anyáktól született bárányoknak csökkent az inzulinjelzése az izomban, összehasonlítva a kontroll bárányokkal, amelyek korreláltak a megnövekedett intramuszkuláris trigliceridekkel és a zsírsav transzporterek és a PPAR magasabb expressziójával-γ [60].
Noha számos tanulmány megvizsgálta a mozgásszervi aktivitás változását az anyák alultápláltsága esetén [61–63], az anyai elhízás modelljeiben az energiafogyasztásra és a fizikai aktivitásra vonatkozó adatokat még nem kellett elvégezni, annak ellenére, hogy számos tanulmány kimutatta az izomfejlődés különbségeit elhízott anyák utódai.
3.4. Placenta funkció
Az placenta működésének megváltoztatása az anyai elhízás hátterében szintén számos vizsgálat középpontjában állt. Csoportunk és mások beszámoltak arról, hogy az anyai HF-diéta eredményeként megváltozott a placenta szerkezete és működése számos kísérleti modellben. A vemhes patkányokban az anyai HF-diéta kimutatta, hogy csökkenti a magzat és a placenta junkcionális zóna növekedését, de nem a placenta labirintus zónájának növekedését [48]. A vemhes juhokban az anyai elhízás jelentősen növeli a placenta zsírsav transzporter expresszióját és a gyulladásos jelátviteli útvonalakat, és fokozza a citokin expressziót a terhesség közepén [57]. Hasonlóképpen, a pávián anyai elhízás az anyai gyulladásos állapothoz kapcsolódik, és strukturális és funkcionális változásokat indukál a méhlepényben [44].
3.5. Beavatkozások
Viszonylag nemrég a fejlesztési programozást a fejlődési pálya visszafordíthatatlan változásának tekintették. Az anyai alacsony fehérjetartalmú modell [64] korai taurin-visszafordítási munkáján kívül kevés adat áll rendelkezésre az intervenciós stratégiákról, legyen szó táplálkozási vagy célzott farmakológiai megközelítésekről. Nemrégiben bebizonyosodott, hogy a leptinnel, folsavval és az exendin-4-vel végzett beavatkozások a fejlődési plaszticitás korai szakaszában enyhíthetik vagy visszafordíthatják a fejlesztés programozásával járó egyes hatásokat [65–67]. Ezeket a szereket azonban az anyák táplálkozáshiányával összefüggésben vizsgálták, és az anyák túlzott táplálkozásának hátterében nem vizsgálták, annak ellenére, hogy az utódok fenotípusai közösek az eltérő táplálkozási modellekben. Hasonlóképpen, a testmozgásnak kedvező hatásai vannak az alultáplált anyák elhízásra hajlamos utódaiban [62, 68], de a mai napig egyetlen tanulmány sem vizsgálta a HF-vel táplált anyák utódaiban végzett gyakorlati beavatkozásokat.
Bizonyíték van az étrend megfordításának az anyai elhízás utódok kimenetelére gyakorolt hatásainak enyhítésében betöltött szerepére. A nem emberi főemlősökben a diéta HF-ről történő átállítása a diéta kontrolljához a terhesség alatt a melanokortin szint normalizálódásához, a magzati máj trigliceridjeinek javulásához és a glükoneogén enzimek expressziójának részleges normalizálásához vezetett. Ezek az eredmények arra utalnak, hogy a normál, alacsony zsírtartalmú étrendre történő áttérés, különösen a terhesség alatt, csökkentheti, de nem szünteti meg a magzati máj steatosis kockázatát [43]. Hasonló eredményeket mutattak ki patkányokban, ahol a terhesség előtti étrendi beavatkozás megfordította az anyagcsere programozását elhízott patkányok hím utódainál [69].
4. Az epigenetika szerepe
Az epigenetikus folyamatok örökletes változásokhoz vezetnek a gén működésében a DNS-kémia szekvenciától független megváltoztatásával, és felelősek lehetnek a szövet-specifikus génexpresszióért a differenciálás során. Az epigenetikus módosítások egy olyan mechanizmus lehet, amely révén a megváltozott intrauterin miliőnek vagy az anyagcsere-zavarnak való kitettség jóval később az életben befolyásolhatja a szervezet fenotípusát [70]. Azt azonban, hogy a négy epigenetikai modalitás - DNS-metiláció, nem kódoló RNS, transzkripciós faktorok és hiszton-módosítások - hogyan járulnak hozzá az epigenetikus memóriához, és hogy az epigenomikus változások hogyan közvetíthetik a magzati génexpresszió megváltozott kontrollját az anyai elhízás következtében.
A rágcsálókon végzett kísérleti adatok és a közelmúltbeli megfigyelések emberen azt sugallják, hogy a szabályozó és növekedéssel összefüggő gének epigenetikai változásai jelentős szerepet játszanak a fejlődés programozásából származó patofiziológiai fenotípusok közvetítésében [71, 72]. A hiszton módosítások a metilációval együtt szabályozzák a kromatin szerkezetét és a génexpressziót. Mindazonáltal továbbra is vitatott, hogy a korai élet és/vagy környezeti tényezők hogyan befolyásolhatják a „hiszton” kódot a DNS-metilációra gyakorolt hatásukhoz hasonló módon [73].
A terhesség vagy a korai újszülöttkori élet hátrányai a kísérleti programozási modellekben a promóter-metiláció változását eredményezik, ezért közvetlenül vagy közvetve befolyásolják a gén expresszióját számos fiziológiai folyamathoz kapcsolódó útvonalakon [74]. Például patkányokban a máj glükokortikoid receptorának (GR) és a PPAR-nak megváltozott promóter-metilációját és a gén expressziójának változását mutatták ki.-α [66, 75], befolyásolja a szénhidrát- és lipid-anyagcserét. Az epigenetikus módosítások fenotípusos hatásai a fejlődés során csak az élet későbbi szakaszaiban jelentkezhetnek, különösen akkor, ha a későbbi környezeti kihívásokra adott válaszokat moduláló génekre, például a HF-diétás étrendi kihívásokra hatnak. A fejlődési ablakok időzítése és az alapvető fiziológiai rendszerek epigenetikus változásainak indukálása nincs jól jellemezve, de úgy tűnik, hogy a perikoncepcionális periódusról [76] a posztnatális életbe is kiterjed [77, 78]. Úgy tűnik, hogy az epigenetikus változás által szabályozott gének közül sok nem klasszikusan be van nyomtatva (az allél szülői eredete szerint kifejezve), bár egyes bejegyzett gének megváltozott expressziót mutathatnak a korai fejlődés során fellépő zavarok után, például ha blasztociszta kultúra in vitro elhúzódó [79].
Kimutatták, hogy a leptin gén promóterét epigenetikus programozásnak vetik alá, és a leptin gén expressziója modulálható DNS metilációval [80–82]. A legújabb tanulmányok arról számolnak be, hogy a terhesség alatt a glükóz tolerancia romlása összefügg a leptin gén DNS metilációjának adaptációival, bár e változások funkcionális jelentősége még nem egyértelmű [83]. Yokomori és mtsai. kimutatta, hogy a specifikus CpG helyek és egy metilációra érzékeny fehérje metilezése hozzájárulhat a leptin gén expressziójának változásához a 3T3-L1 sejtekben az adipocita differenciálódás során [84]. Ezenkívül differenciális DNS-metilációt figyeltek meg a glükóz-anyagcserében részt vevő gének promóterében, beleértve a GLUT4-et [85] és a szétkapcsolódó fehérjét (UCP) -2 [86], amelyek mindkét fő hozzájárulás a T2DM kialakulásához.
A fejlődési epigenetikáról úgy gondolják, hogy „adaptív fenotípusokat” hoznak létre, hogy megfeleljenek a későbbi életkörülmények követelményeinek [73, 87]. Ebben a koncepcióban implicit módon az okság fontos folyamata a sejtek szintjén, szabályozza a növekedést és a szövetek differenciálódását, és magában foglalja a DNS vagy a kapcsolódó fehérjék kémiai változását. Miután megértették a betegség mechanisztikus alapjait, az epigenetikus folyamatok potenciálisan visszafordíthatók, és a megfordításra irányuló beavatkozást és stratégiákat lehet kidolgozni és megvalósítani. Egy nemrégiben készült felvetés szerint a metabolikus betegség kockázatának jelentős része prenatális fejlődési alapú, és a perinatális epigenetikai elemzés hasznos lehet a későbbi elhízás és anyagcsere-betegség iránti egyéni sérülékenység azonosításában [88]. Ebben a tanulmányban összefüggést jelentettek a köldökzsinór retinoid x-receptor alfa (RXRA) gén promoter-metilációja és a gyermekkori zsírosodás későbbi kockázata között.
5. Atyai közvetítés
6. Összefoglalás
Köszönetnyilvánítás
A szerzők elismerik a Nemzeti Növekedési és Fejlesztési Kutatóközpont, az Új-Zéland Egészségügyi Kutatási Tanács, az Új-Zélandi Királyi Társaság Marsden Alapjának és a Kutatási Tudomány és Technológia Alapítvány támogatását.
Hivatkozások
- Az anyák elhízása egész életen át tartó anyagcsere eredménye gyenge fejlődési pályák utódai számára
- Az anyai elhízás növeli az anyagcsere-betegségek kockázatát az utódokban, patkánykutatási kiállítások
- Anyai táplálkozás és az elhízás programozása
- Van-e helye a Q koenzimnek az elhízással járó anyagcserezavarok kezelésében?
- Az anyák programozása a terhesség alatt hosszú távú elhízást vált ki