Antibiotikumok, gyermekdiszbiózis és betegség
Pajau Vangay
1 Orvosbiológiai és informatikai biológia, Minnesotai Egyetem, Minneapolis, MN 55455, USA
Tonya Ward
2 Biotechnológiai Intézet, Minnesotai Egyetem, Saint Paul, MN 55108, USA
Jeffrey S. Gerber
3 fertőző betegségek osztálya, Philadelphia Gyermekkórház, Philadelphia, PA 19104, USA
Dan Knights
2 Biotechnológiai Intézet, Minnesotai Egyetem, Saint Paul, MN 55108, USA
4 Számítástudományi és Mérnöki Tanszék, University of Minnesota, Minneapolis, MN 55455, USA
Absztrakt
Az antibiotikumok messze a leggyakoribb gyógyszerek, amelyeket a gyermekek számára írnak fel. A legújabb epidemiológiai adatok összefüggést sugallnak a korai antibiotikum-használat és a betegség fenotípusai között felnőttkorban. Az antibiotikumok csecsemőkorban történő alkalmazása egyensúlyhiányt okoz a bél mikrobiotájában, az úgynevezett dysbiosis. A bélmikrobiomának az antibiotikumokra adott válaszai és a betegség kialakulásával való potenciális kapcsolata különösen bonyolult a változó csecsemőbélben. Itt szintetizáljuk az antibiotikumokat, a dysbiosist és a betegségeket összekapcsoló jelenlegi ismereteket, és javaslatot teszünk egy keretrendszerre az antibiotikumokkal kapcsolatos dysbiosis gyermekeknél történő tanulmányozására. Jövőbeli vizsgálatokat javasolunk az antibiotikumok mikrobiom által közvetített hatásaira vonatkozóan, amelyek a dysbiosis négy típusára összpontosítanak: a kulcskő taxonok elvesztése, a sokféleség elvesztése, az anyagcsere kapacitás elmozdulása és a kórokozók virágzása. A gyermekkori dysbiosis diagnózisának, értelmezésének és esetleges kezelésének elősegítéséhez elengedhetetlen egy nagy és változatos kiindulási kohorsz létrehozása az egészséges csecsemő mikrobioma fejlődésének meghatározására. Ez a megközelítés segíteni fog bizonyítékokon alapuló ajánlások nyújtásában az antibiotikumok csecsemőkori használatára vonatkozóan.
Bevezetés
Az antibiotikumok messze a leggyakoribb vényköteles gyógyszerek, amelyeket gyermekeknek adnak (Chai et al., 2012). Az epidemiológiai vizsgálatok összefüggéseket állapítottak meg az antibiotikumok korai csecsemőkorban történő használata és az olyan betegségek előfordulása között, mint az elhízás, a cukorbetegség és az asztma a későbbi életben. Az antibiotikumok használatával kapcsolatos longitudinális vizsgálatok kimutatták az antibiotikumok mélyreható rövid és hosszú távú hatásait a bél mikrobiota sokféleségére és összetételére. Végül számos és egyre növekvő számú tanulmány oksági szerepet játszik a mikrobiom egyensúlyhiányában (dysbiosis) számos betegségben (Biedermann és Rogler, 2015). A korai életkori antibiotikumok használatának a bél mikrobiotájának sokféleségére és összetételére gyakorolt rövid és hosszú távú hatásainak megértése kritikus jelentőséggel bír a felmerülő vényrendszerekkel kapcsolatos kockázatok azonosításában. Azonban a meglévő szakirodalom korlátozott a mikrobiális dysbiosis közvetlen összefüggésében, mint a gyermekkori antibiotikumok és a későbbi életben kialakuló betegség közötti kapcsolat.
Ebben az áttekintésben számos kiegészítő forrást szintetizálunk, beleértve az antibiotikumokat és a dysbiosist összekapcsoló mikroökológiai vizsgálatokat, a dysbiosis specifikus típusait a betegség konkrét eredményeivel összekapcsoló mechanisztikus vizsgálatokat, valamint az antibiotikumokat és a megnövekedett betegségkockázatot támogató epidemiológiai vizsgálatok áttekintését. Ezzel a megközelítéssel az antibiotikumokkal kapcsolatos dysbiosis négy fő típusát azonosítottuk, és bemutattunk egy keretet a gyermekkori dysbiosis megbeszélésének és mérésének számos fő betegség összefüggésében. Elemzéseink jelentős meglévő bizonyítékot mutatnak számos olyan oksági mechanizmusra, amelyek révén a mikrobiom közvetíti az antibiotikumokkal kapcsolatos betegség kockázatát.
Az antibiotikumok túlzott használata
Az antibiotikumok túlnyomó többsége járóbeteg-környezetben fordul elő, ahol a receptek legfeljebb egyharmada felesleges. 2010-ben a gyermekek 74,5 millió ambuláns antibiotikum-receptet kaptak - az Egyesült Államokban minden gyermek számára egyet -, ami a gyermekek számára szedett gyógyszerek egynegyedét teszi ki (Hicks et al., 2013). Számos tanulmány kimutatta, hogy az antibiotikumokat gyakran feleslegesen írják fel (Gonzales és mtsai, 2001; McCaig és mtsai, 2003; Nash és mtsai, 2002), becslések szerint akár 50% is (Kronman és mtsai, 2014). A gyermekek csaknem 30% -a kap ambuláns alapellátási látogatás során antibiotikumot (McCaig et al., 2003), leggyakrabban nem megfelelő módon a felső légúti vírusfertőzések miatt (Gonzales et al., 2001; Nash et al., 2002; Nyquist és mtsai., 1998). A széles spektrumú antibiotikumok túlzott használata a keskeny spektrumú szerekre érzékeny körülmények között drámaian növekszik (Hersh et al., 2013). A beteg életkorának, a társbetegségeknek és a szociodemográfiai tényezőknek való megfelelés után is az azonos fertőzésekben szenvedő gyermekek az alkalmazott gyakorlattól vagy klinikától függően nagyon különböző arányban kaphatnak antibiotikumot (Fierro et al., 2014; Gerber et al., 2014) . Ez a jelenség szintén univerzálisnak tűnik: az egy főre eső antibiotikum-felírási arány az egyes államokban (Hicks és mtsai., 2013) és európai országokban (Goossens és mtsai., 2005) nagyon eltérő, ésszerű ok nélkül a bakteriális fertőzések arányának földrajzi különbségeire.
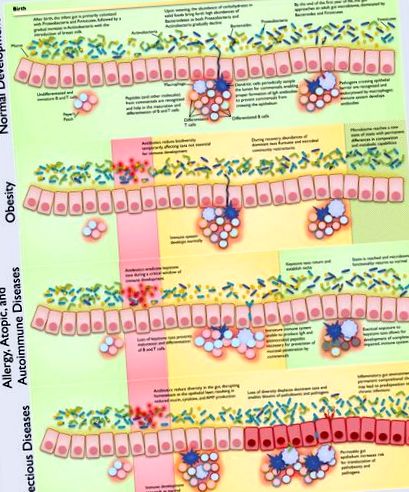
Normál Host-Microbiome fejlesztés
Emésztőrendszeri fejlődés
A GI-asszociált limfoid szövet (GALT), beleértve a mesenterialis nyirokcsomókat, a Peyer-foltokat és a lamina propria limfocitáit, kifejlődött teljes idejű csecsemőknél születésükkor (Forchielli és Walker, 2005). Például a mucin termeléséért felelős serlegsejtek a terhesség 12. hetében működőképesek (Montgomery és mtsai., 1999), csakúgy, mint a paneth sejtek, amelyek defenzineket és lizozimokat képesek kiválasztani a 13. és 20. terhességi hétre (Louis és Lin (Maheshwari és Zemlin, 2009; Rumbo és Schiffrin, 2005). Bár teljes idejű csecsemők teljesen fejlett emésztőrendszerrel születnek, az étrendi antigéneknek, hormonoknak, növekedési faktoroknak és baktériumoknak való expozíció révén exogén stimulációra van szükség a megfelelő működés kiváltásához az egész életen át (Forchielli és Walker, 2005).
Mikrobiom fejlesztés
A betegségosztályok lépcsőzetes dysbiosis típusokhoz kapcsolódnak, fontos függőséggel a gazdaszervezet mikrobioma fejlődésének folyamatától. Vegye figyelembe, hogy a betegségosztályok és a dysbiosis típusai nem feltétlenül zárják ki egymást. A bemutatott javasolt mechanizmusokat a szakirodalomban átfogó bizonyítékok támasztják alá, mind a mechanisztikus vizsgálatokból, mind az epidemiológiai felmérésekből. A nagyon sok hivatkozás miatt az ábrán bemutatott idézetek az 1. táblázatban találhatók .
Fontos gazda-mikrobiom kölcsönhatások
A bél immunrendszerének érése a bél mikrobiomjának párhuzamos fejlődésétől függ (1. ábra); csíra mentes állatokat találtak jelentős immunológiai hibákkal a GALT-ban (Macpherson és Harris, 2004), valamint a Peyer-foltok és a mesenterialis nyirokcsomók nem megfelelő fejlődésével (Round and Mazmanian, 2009). A Peyer-foltok és a mesenterialis nyirokcsomók prenatálisan fejlődnek, és az izolált lymphoid tüszők posztnatálisan fejlődnek, de ezeknek a szöveteknek a bél mikrobiom kulcsfontosságú tagjaival való kölcsönhatásra van szükségük az adaptív immunitás megfelelő differenciálásának és specifikációjának, valamint teljes kialakulásának biztosítása érdekében (Cherrier és Eberl, 2012; Maynard et al., 2012). Az immunrendszernek gyulladáscsökkentő állapotot kell fenntartania (Tsuji és Kosaka, 2008) a bélben, különösen a kommenzálokból, hormonokból és táplálékból származó számos ártalmatlan antigénnek való kitettség során.
A mikrobiómák fejlődésének egyéb főbb hatásai
A szülés módja hatással van a csecsemők mikrobiomjára, mivel a hüvelyi úton leadott csecsemők teljes mikrobioma (bőr, szájnyálkahártya, nasopharyngealis aspirát és meconium) hasonlít az anyai hüvelyi és bélmikrobiomára, míg a császármetszéssel szült csecsemők teljes mikrobiómája hasonlít az anyai bőr mikrobiómája (Dominguez-Bello et al., 2010). Konkrétan, a hüvelyi úton szült csecsemők mikrobiómái többnyire Lactobacillus, Prevotella, Atopobium vagy Sneathia spp-ből állnak, míg a császármetszéssel szedett csecsemők mikrobiómája Staphylococcus spp-t (Dominguez-Bello et al., 2010) és kevesebb Bifidobacteriumot (Biasucci et al., 2010).
Keretek a gyermekkori diszbiózis és a kapcsolódó betegségek tanulmányozásához
A gyermekkori dysbiosis mechanizmusai és egészségügyi következményei összetettek és multifaktoriálisak, és még bonyolultabbak, ha figyelembe vesszük a csecsemő fejlődését (a bél mikrobiómája, az immunrendszer és ezek kölcsönhatásai) is. Rendszeres megközelítést alkalmazva öt egymásra épülő keretet veszünk figyelembe a dysbiosis megértéséhez, amelyek a betegséghez vezető mechanizmusok különböző aspektusaira összpontosítanak. Ezeket a fogalmi kereteket megvitatjuk az egyértelműség, a szerveződési potenciál és a többtényezős betegségút kifejező képességének relatív előnyei szempontjából. Hipotéziseinket azokra korlátozzuk, amelyek egy vagy több rövid, különálló antibiotikum-kúra hosszú távú egészségügyi hatásait feltételezik, mivel ez messze a leggyakoribb típusú antibiotikum-expozíció az emberi gyermekeknél (Gevers et al., 2014). Minden perspektíva erőssége abban, hogy általánosítani tudja a gyermekkori dysbiosis bizonyos aspektusait. Általában a dysbiosis-központú és a betegség-centrikus perspektívák kombinációját találjuk a leghasznosabbnak a betegség mechanizmusainak megvitatásához.
Dysbiosis-központú nézet
Betegségközpontú nézet
Korcentrikus nézet
A diszbiózis teljes gyógyulással és a befogadó egészségének minimális hatásával oldódhat meg, vagy drasztikus, nem szándékos következményekkel járhat, a fogadó fejlődésének stádiumától függően. A mikrobiom és a gazda immunrendszer fejlődése kényelmesen, bár megközelítőleg, négy általános szakaszba sorolható: (1) 0–6 hónap, (2) 6–12 hónap, (3) 12–24 hónap és (4) 24 hónapos és idősebb. A csecsemő a legsebezhetőbb az immunológiai hibák kialakulásában az 1. szakaszban, amikor a kulcsfontosságú taxonokkal az adaptív immunitás kölcsönhatása a legkritikusabb (van der Velden et al., 2001; Prescott et al., 1999; Rautava et al., 2004). A 4. szakaszban a bélmikrobiom új érettségit hoz létre az érettség elérésekor, végrehajtva minden olyan létező funkcionális elmozdulást, amely hajlamosíthatja a gazdát a jövőbeli betegségekre. Bár az egyes fejlődési szakaszok sebezhetőségei fontos szempontok a dysbiosis megértéséhez, az elkülönített szakaszok figyelembevétele akadályozza a több szakaszból álló mechanizmusok jellemzését.
Válaszközpontú nézet
(A) A csecsemőbél mikrobiómái gyorsan fejlődnek és nagy változásokat tapasztalnak csecsemőkorban, mielőtt 2 éves korukra megkülönböztethetőek lennének a felnőtt mikrobiómáitól. A csecsemők diszbiózisa a normális növekedési pályán kiszoríthatja (nem gyógyulhat meg) vagy késleltetheti (lassú helyreállítást).
(B) A mintákat egyetlen csecsemőtől vettük idővel (Koenig és mtsai, 2011; és a mikrobiómák távolságát (Bray-Curtis) 2 éves korukig idővel ábrázoltuk. Az antibiotikumok után azonnal gyűjtött székletmintákat kékkel jelöltük Egy simító spline (világoskék színnel) észrevehető változást mutat a fejlődési pályán az antibiotikumok alkalmazása után, tükrözve a 2A.
Helyreállítás-központú nézet
A gyermekkori diszbiózissal társult betegség mechanizmusainak jelenlegi bizonyítékai
Több alternatív lencse megvizsgálása révén, amelyeken keresztül megvitathatjuk és megszervezhetjük a gyermekkori dysbiosist, úgy döntöttünk, hogy a dysbiosis-központú és a betegség-központú perspektívák kombinációját alkalmazzuk a lehetséges betegség mechanizmusairól szóló meglévő ismeretek összegzésére és szintetizálására (1. táblázat). Ez a kombinált keretrendszer lehetővé teszi számunkra, hogy ugyanazon betegségnek több okát feltérképezzük, miközben nyomon követjük a különböző ismert vagy javasolt mechanizmusok hátterében álló különböző fejlődési és kezelési szakaszokat. Bár a dysbiosis és a betegség közötti oksági út sokféle formát ölthet, négy fontos betegségosztályt mutatunk be a fő járulékos dysbiosis típusokban.
Asztal 1
Referenciák Az antibiotikumokat, a bél mikrobiómájának változását és a betegséget összekapcsoló mechanikus és epidemiológiai bizonyítékok szintetizálása
| Fertőző betegségek | |
| Antibiotikumok és betegségek | Ayres és mtsai, 2012; Brandl és mtsai, 2008; Buffie és mtsai, 2012; Croswell és mtsai, 2009; Noverr és mtsai, 2004; Deshmukh és mtsai, 2014; Lawley és mtsai, 2008; Sekirov et al., 2008 |
| Antibiotikumok és mikrobiom | Ayres és mtsai, 2012; Brandl és mtsai, 2008; Buffie és mtsai, 2012; Croswell és mtsai, 2009; Deshmukh és mtsai, 2014; Donskey és mtsai, 2000; Lawley és mtsai, 2008; Noverr és mtsai, 2004; Sekirov et al., 2008 |
| Mikrobioma és betegség | Abt és mtsai, 2012; Asahara és mtsai, 2001; Buffie és mtsai, 2012; Deshmukh és mtsai, 2014; Lawley és mtsai, 2008; Mai és mtsai, 2011; Mazmanian és mtsai, 2008; Shu és mtsai, 2000; Wang et al., 2009 |
| Allergiás, atópiás és autoimmun betegségek | |
| Antibiotikumok és betegségek | Droste és mtsai, 2000; Horton és mtsai, 2014; Hviid et al., 2011; Johnson és mtsai, 2005; Marild és mtsai, 2013; McKeever és mtsai, 2002; Ong és mtsai, 2014; Russell és mtsai, 2012; Stefka és mtsai, 2014 |
| Antibiotikumok és mikrobiom | Arnold és mtsai, 2011; Russell és mtsai, 2012; Stefka és mtsai, 2014 |
| Mikrobioma és betegség | Arnold és mtsai, 2011, Abrahamsson és mtsai, 2012; Atarashi és mtsai, 2013; Bisgaard és mtsai, 2011; Bjorksten és mtsai, 2001; Cani és mtsai, 2008; Giongo és mtsai, 2011; Lee és Mazmanian, 2010; Lundell és mtsai, 2014; Olszak és mtsai, 2012; Russell és mtsai, 2012; Sellitto és mtsai, 2012; Sjögren et al., 2009; Stefka és mtsai, 2014; Wen és mtsai, 2008; Wu és mtsai., 2010 |
| Elhízottság | |
| Antibiotikumok és betegségek | Ajslev és mtsai, 2011; Bailey és mtsai, 2014; Cho és mtsai, 2012; Cox és mtsai, 2014; Trasande és mtsai, 2013 |
| Antibiotikumok és mikrobiom | Ajslev és mtsai, 2011; Cho és mtsai, 2012; Cox és mtsai, 2014 |
| Mikrobioma és betegség | Ajslev és mtsai, 2011; Cho és mtsai, 2012; Cox és mtsai, 2014; Ley és mtsai, 2006; Ridaura és mtsai, 2013; Turnbaugh et al., 2009 |
Elhízottság
Allergia és atópiás rendellenességek
Autoimmun betegség
Fertőző betegségek
- Alkoholos májbetegség Információ a Sínai-hegy - New York
- Reggeli krónikus vesebetegségért Vese diéta menü székhelye
- 10 étel hozzáadása az autoimmun betegség étrendjéhez TheHarmin
- Alopecia areata és a lisztérzékenység A gluténmentes étrendnek nincs hatása a haj növekedésére - absztrakt -
- 10 étel a kutyák betegségei ellen