A hasnyálmirigy béta-sejtének öregedése hozzájárul a 2-es típusú cukorbetegség patogeneziséhez magas zsírtartalmú étrend által kiváltott diabéteszes egerekben
Absztrakt
Célok/hipotézis
A 2-es típusú cukorbetegség patogenezise során az inzulinrezisztencia a béta-sejtek kompenzációs szaporodását okozza. Mivel a béta-sejtek korlátozott replikációs potenciállal rendelkeznek, ez a kompenzációs proliferáció felgyorsíthatja a sejtek öregedését és cukorbetegséghez vezethet. Megvizsgáltuk a béta-sejtek sejtes öregedését a lipoglükotoxicitás során történő szaporodás után.
Mód
A béta-sejtekben előforduló szenzenciához kapcsolódó markereket tápanyag-indukált diabéteszes C57BL/6J egerekben vizsgálták, amelyek zsírtartalmú étrendet kaptak. 4 és 12 hónapos, magas zsírtartalmú étrend után intraperitoneális glükóz tolerancia teszteket (IPGTT), valamint a Ki-67, p38, az öregedéshez kapcsolódó béta-galaktozidáz és a béta sejtek hisztokémiai elemzését hajtották végre.
Eredmények
4 hónap múlva a plazma inzulinszint AUC-értéke az IPGTT során (AUCinsulin) magasabb volt, a béta-sejtek tömege 3,1-szer nagyobb, a béta-sejtek proliferációja 2,2-szer nagyobb volt, mint a kontroll csoportban. A 12. hónapban azonban az AUCinsulin csökkent, a Ki-67-pozitív béta-sejtek gyakorisága a kontrollcsoport egyharmadára csökkent, és az öregedéssel társult, béta-galaktozidáz-pozitív terület 4,7-szeresére nőtt. ellenőrző csoport. Ezenkívül kis mennyiségű p38-t, amelyet oxidatív stressz indukál és közvetíti a sejtek öregedését, a magas zsírtartalmú étrend-csoport béta-sejtjeiben találtak, a kontrollcsoport béta-sejtjeiben azonban nem. Ezenkívül a magas zsírtartalmú étrendben az öregedéshez társult, béta-galaktozidáz-pozitív terület nagyon szignifikáns negatív korrelációt mutatott az AUCinsulinnal (r= −0,852, o
Bevezetés
A 2-es típusú diabetes mellitusban az inzulin szekréciójának hiányát a béta-sejtek diszfunkciója és a csökkent béta-sejtek tömege okozza. A béta-sejtek diszfunkcióját krónikus hiperglikémia és/vagy hiperlipidémia okozza, amelyeket glükotoxicitásnak és lipotoxicitásnak neveznek, amelyeket korábban részletesen áttekintettek [1–3].
A béta-sejtek tömegének hosszú távú szabályozását a béta-sejtek növekedésének egyensúlya határozza meg, beleértve a replikációt és a neogenezist, valamint az apoptózis, nekrózis és öregedés révén bekövetkező béta-sejt-veszteséget [4–7]. Csökkent béta-sejt tömeg fordul elő 2-es típusú cukorbetegségben és 2-es típusú cukorbetegség állatmodelljeiben [6–12]. A krónikus hiperglikémia a béta-sejtek tömegének progresszív csökkenéséhez vezet, a béta-sejtek apoptózisának hosszan tartó növekedésével a béta-sejtek növekedésének kompenzációs növekedése nélkül. A nekrózis mellett a jelentősen megnövekedett béta-sejt apoptózist tekintik a cukorbetegség patogenezisének egyik fő tényezőjének. A fokozott béta-sejt apoptózis sejtmechanizmusait, amelyek magukban foglalják a hiperglikémia által kiváltott oxidatív stresszt [8, 12], intenzíven tanulmányozzák [13–18].
Anyagok és metódusok
Állatok
A hathetes C57BL/6J hím egereket a Clea Japan-tól (Tokió, Japán) vásároltuk. A kontroll csoport normál étrendet (AIN-93; 14% fehérje, 72% szénhidrát, 4% zsír) [27] táplált, szabad hozzáféréssel a vízhez. A magas zsírtartalmú étrend-csoport ingyenes hozzáférést kapott a magas zsírtartalmú étrendhez, amelyben a marhahús faggyú a normál étrend szénhidrátjainak 36% -át pótolta (magas zsírtartalmú étrend: 14% fehérje, 36% szénhidrát, 40% zsír). Az egereket szabályozott hőmérsékletű helyiségben helyeztük el, 12 órás világos-sötét ciklus mellett. Valamennyi kísérletet a Kagawa Táplálkozási Egyetem Állatetikai Bizottsága hagyta jóvá, és megfelelt a „Laboratóriumi állatgondozás alapelveinek” (NIH, 85–23. Kiadvány, átdolgozva 1985).
Vérelemzés és glükóz tolerancia tesztek
Az intraperitoneális glükóz tolerancia teszthez (IPGTT) az egerek 12 órán keresztül éheztek, és a vért a farokvénából 0, 30, 60 és 120 perc múlva vezették be i.p. injekció glükóz (2 g/testtömeg-kg). A plazma lipidek méréséhez a vért a farokvénából az i.p. glükóz injekció. A plazma glükózt, a NEFA-t, a triglicerideket és az összes koleszterint kereskedelmi készletekkel mértük (Wako Pure Chemical Industries, Osaka, Japán). A plazma inzulint patkány inzulin enzim immunvizsgálati rendszerrel mértük (Amersham Biosciences, Piscataway, NJ, USA). Minden időpontban vérmintákat (kb. 70 μl) vettünk egy kapilláris csőben, kivéve a 0 időpontban vett vérmintákat (kb. 100 μl 1,5 kapilláris csőben). Az egerek kis testtömege miatt a mikroanalízishez szükséges vérmennyiség csak 2 μl volt, az inzulinanalízisek kivételével (20 μl). A trapézszabályt alkalmazták az egyes állatok glükóz- és inzulinkoncentrációjának AUC-jának meghatározására. Az inzulinogén index kiszámításához az IPGTT alatti plazma inzulinszint AUC-értékét (AUCinsulin) elosztjuk az IPGTT alatti plazma glükózszintjének AUC értékével (AUCglucose) (0–30 perc).
Szigetek elkülönítése és szigetek vizsgálata
A szigeteket kollagenáz emésztéssel izoláltuk a hasnyálmirigyből, és 4 és 12 hónapos magas zsírtartalmú étrend után mikroszkóp alatt gyűjtöttük őket. A szigeteket 12 órán át tenyésztettük 11,1 mmol/l glükózt, 10% hő-inaktivált szarvasmarha-magzati szérumot, 100 NE/ml penicillint és 100 μg/ml sztreptomicint tartalmazó RPMI 1640 táptalajban, amint azt korábban leírtuk [28, 29]. Ezután a méretnek megfelelő szigeteket 60 percig inkubáltuk 37 ° C-on 0,2% BSA-t és 2,8 mmol/l glükózt tartalmazó KRB-vel. Előinkubálás után 10 szigetet stimuláltunk KRB-vel a jelzett glükózkoncentráció mellett 1 órán át 37 ° C-on. Közvetlenül ezután a felülúszót összegyűjtöttük és -80 ° C-on tároltuk az inzulinvizsgálatig. Ezután a szigeteket háromszor PBS-sel mostuk és savas etanollal (0,18 mol/l HCl 95% etanolban) homogenizáltuk az inzulin tartalom meghatározása céljából.
Immunhisztokémiai elemzés
Hasnyálmirigy-szigetek morfológiája
A béta-sejtek morfometriai elemzéséhez az egyes hasnyálmirigyek három szakaszát szisztematikusan lefedtük, átfedés nélküli mezőkről készített képek rögzítésével digitális fényképezőgéppel (Nikon 950; Nikon, Tokió, Japán). A szigetecske területét és a metszet területét az NIH Image 1.63 szoftver segítségével elemeztük, a korábban leírtak szerint [30]. A szigeti területen a béta-sejtek területének százalékos arányát úgy számítottuk ki, hogy az összes inzulin-pozitív sejt területét elosztottuk a szigetecske területével, és megszoroztuk 100-mal. A szigetecske tömegét úgy számítottuk ki, hogy a hasnyálmirigy súlyát megszoroztuk a hasnyálmirigy/szigetek százalékával. A béta-sejt tömegét úgy számítottuk ki, hogy a szigetecske tömegét megszoroztuk az egy szigetre eső béta sejtek százalékával. Az exokrin csatornák sejtjeiből származó béta-sejtek neogenezisének relatív arányának felméréséhez számszerűsítettük az exokrin csatornák sejtjeinek százalékos arányát, amelyek immunreaktívak voltak az inzulinra vonatkozóan, a korábban leírtak szerint [31]. A kapott adatokat az összes hasnyálmirigyben inzulin szempontjából pozitív csősejtek százalékában fejeztük ki, és az átlagokat minden csoportra kiszámoltuk.
Béta sejtek szaporodása
Szigetenként számított béta-sejt replikációt az inzulin és a Ki-67 foltok összehasonlításával és a ki-67 pozitív béta sejtek számának átlagolásával egérenként körülbelül 80 szigetről.
Sejtes öregedés detektálása
A sejtes öregedést immunhisztokémiai módszerrel, celluláris öregedési marker-foszfo-p38-mal és öregedéssel társított béta-galaktozidáz (SA béta-gal) festéssel értékeltük. Az immunhisztokémiai módszerrel meghatározott béta-sejt öregedés gyakoriságát a sejtek replikációjára leírt módszerrel számoltuk. Az SA béta-gal kimutatását a korábbiakban leírtak szerint végeztük [32], kisebb módosításokkal. A kísérleti időszak 12 hónapja után a hasnyálmirigyeket 3 órán át 4% paraformaldehidben 4 ° C-on fixáltuk, és egy éjszakán át 30% szacharózt tartalmazó PBS-ben (pH 7,2) helyeztük 4 ° C-on, szövet-Tek OCT vegyületbe ágyazva (Miles, Elkhart, IN, USA), fagyasztva, és hűtve tartott mikrotomával 8 μm vastag szeletekre osztjuk. Az SA béta-gal-t egy öregedés detektáló készlettel (BioVision, Mountain View, CA, USA) detektáltuk, és ellenfestettük a Kernechtrot-tal. Minden hasnyálmirigy esetében a szigetek képeit két szakaszban, egymástól 200 μm-rel elválasztva, digitális kamerával (Nikon) rögzítették. A szigetek SA béta-gal-pozitív területét és a szigetecske területét az NIH Image 1.63 szoftver segítségével elemeztük, a korábban leírtak szerint [30]. Az SA béta-gal-pozitív terület százalékos arányát úgy számítottuk ki, hogy a szigeteken lévő SA béta-gal-pozitív területet elosztottuk a szigetek területével, és megszoroztuk 100-mal.
Apoptózis kimutatása
Az apoptózis kimutatásához három, 200 μm-rel elválasztott szakaszt (3 μm) festettünk a terminális dezoxinukleotidil-transzferáz által közvetített dUTP nick-end jelölés (TUNEL) módszerrel, in situ apoptózis detektáló készlet segítségével (Wako Pure Chemical Industries, Japán). DAB-t használtunk szubsztrát-kromogénként. A hasnyálmirigy-szigetsejtek apoptózisának gyakoriságát, amelyet egy szigetenként eseményként fejeztünk ki, úgy számítottuk, hogy átlagoltuk a TUNEL-pozitív béta-sejtek számát az egyes hasnyálmirigyek körülbelül 60 szigetén.
Statisztikai analízis
Az összes adatelemzést a StatView 5.0 (SAS Institute, Cary, NC, USA) segítségével végeztük. Az adatokat átlag ± SEM-ként mutatjuk be. Korrelációs elemzést végeztek a sejtek öregedése és a sejtek proliferációja, az AUCglukóz, AUCinsulin, inzulinogén index vagy p38 mitogén-aktivált protein-kináz (MAPK) között. A korrelációs együtthatók jelentőségét Fisher's elemezte z-átalakítás. A többi adat statisztikai elemzését a Mann – Whitney-vel végeztük U-teszt. Megfontoltuk o 0,05 alatti értékek statisztikailag szignifikánsak.
Eredmények
Testtömeg, vérvizsgálatok és glükóz tolerancia tesztek
A testsúly, a plazma glükóz, az inzulin, a NEFA, a trigliceridek és az összkoleszterin mennyisége az étrend 4. és 12. hónapja után mérve az 1. táblázatban található. A zsírtartalmú étrendben a testtömeg szignifikánsan magasabb volt, mint a kontroll csoportban 4 és 12 hónap után. A diéta 12 hónapja (o 1. táblázat A testsúly, a plazma trigliceridek, a NEFA, a teljes koleszterin, a glükóz és az inzulin szintje a C57BL/6J egerekben 4 és 12 hónapos, magas zsírtartalmú étrend előtt és után.
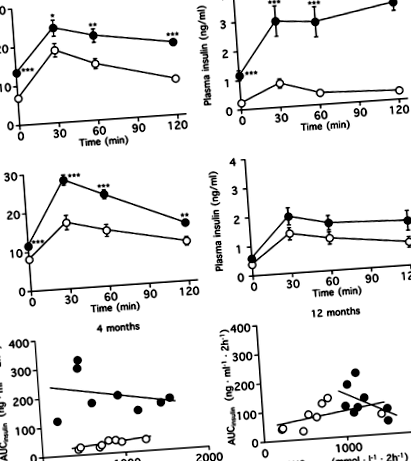
Az IPGTT-ket 4 és 12 hónapos étrend után végeztük el, és értékeltük AUCglucose, AUCinsulin és inzulinogén index alapján (1. ábra, 2. táblázat). A 4. hónapban a plazma glükóz- és inzulinszintje szignifikánsan magasabb volt a magas zsírtartalmú étrendben, mint a kontroll csoportban. A magas zsírtartalmú étrendben az AUCinsulin 6,6-szorosára nőtt a kontrollcsoportéval (o 1. ábra
Sziget tanulmányok
A diéták 4 és 12 hónapja után az inzulin felszabadulást glükózzal stimulálták a statikus inkubációs kísérletek során, és a szigetek inzulin tartalmát megmérték (2. ábra). A magas zsírtartalmú étrendben 4 hónapos korban az inzulin felszabadulás szintje 16,7 és 33,4 mmol/l glükóz (2,02 ± 0,10, illetve 2,82 ± 0,21 ng szigetecske –1 h –1) által indukált; o −1 h −1). A 12. hónapban azonban a magas zsírtartalmú étrendben 16,7, illetve 33,4 mmol/l glükózzal stimulált inzulin felszabadulás szintje (0,76 ± 0,13, illetve 1,13 ± 0,25 ng szigetecske –1 h –1) majdnem megegyezett a kontrollcsoportba tartozók (0,91 ± 0,10, illetve 1,35 ± 0,08 ng szigetecske –1 h –1, ill. Hasonlóképpen, a kontroll csoporthoz képest a magas zsírtartalmú diétás csoport szigeteinek inzulintartalma 4 hónapon belül szignifikánsan megnőtt (58,0 ± 5,17 és 36,1 ± 0,73 ng/szigetecske), o 2. ábra
Béta-sejtek tömege és szaporodása
A béta-sejt tömegének és proliferációjának morfometriai elemzését immunhisztokémiai analízissel végeztük 4 és 12 hónapon belül. 4 hónap elteltével a zsírtartalmú étrend hasnyálmirigyének szigetterülete 2,2-szer nagyobb volt, mint a kontroll csoportban, és a szigeteken a béta-sejtek relatív megoszlása kissé, de szignifikánsan megnőtt a kontrolléhoz képest csoport (o 3. táblázat C57BL/6J egerek hasnyálmirigyének morfometriai elemzése 4 és 12 hónapos, magas zsírtartalmú étrend után
A Ki-67 fehérje kettős festése (barna) és inzulin (halványpiros) a C57BL/6J egerek paraffinba ágyazott szakaszainak szigeteiben 4 és 12 hónapos kontroll étrend után (a, c) és a magas zsírtartalmú étrend (b, d). SA béta-gal festés fagyasztott szakaszok szigeteiben C57BL/6J egerekből 12 hónapos kontroll étrend után (e) és a magas zsírtartalmú étrend (f). C57BL/6J egerek inzulinnal festett, csatornával társult béta sejtjei 4 (g) és 12 (h) hónapokig tartó zsírtartalmú étrend. Eredeti nagyítás × 300 (rúd= 40 μm)
4 hónap múlva (a Ki-67-pozitív béta-sejtek/szigetecskék gyakoriságával értékelve) a magas zsírtartalmú étrend-csoportban a béta-sejtek szaporodása 2,2-szer nagyobb volt, mint a kontroll csoportban, hogy ellensúlyozza a megnövekedett inzulinigényt (o 4. ábra
Béta-sejt öregedés és apoptózis
A szigetek sejtes öregedését és apoptózisát 12 hónapos zsírtartalmú étrend után értékeltük (5. ábra). A magas zsírtartalmú diétás csoport szigeteiben az SA béta-gal-pozitív területének százalékos aránya 4,7-szerese volt a kontroll csoportéinak (a szigetek területének 12,4 ± 3,7% és 2,4 ± 0,4% -a), o 5. ábra
Korreláció a sejtek öregedése és proliferációja, AUCglukóz, AUCinsulin, inzulinogén index és p38 MAPK között
Amint a 6. ábra mutatja, az SA béta-gal-pozitív terület százalékos aránya szignifikánsan korrelált a Ki-67-pozitív béta-sejtekkel és az AUCglukózzal (r= −0,864, o 6. ábra
Vita
A zsírsejtes táplálékkal etetett egerekben megnőtt a béta sejtekben a sejtek öregedésének markerei. A béta-sejtek öregedését megelőzően fokozott proliferációt figyeltek meg hiperglikémiás körülmények között. Rendkívül negatív összefüggés volt a sejtszaporodás és az öregedés között. Ezek a megállapítások azt mutatják, hogy a sejtek öregedése a béta sejtek gyors szaporodása után következik be, és csökkent sejtszaporodást és béta sejt tömeget okoz.
A csökkent hasnyálmirigy-béta-sejt tömeg a 2-es típusú cukorbetegség patogenezisében, valamint a béta-sejtek diszfunkciójában fontos tényező. A béta-sejtek hosszú távú szabályozása a replikációból és a neogenezisből, a főleg az apoptózisból eredő béta-sejtek egyensúlyából függ [4–7]. A hyperglykaemiához való alkalmazkodáshoz a 2-es típusú cukorbetegség patogenezise során a fokozott béta-sejtproliferáció a béta-sejtek tömegének kompenzációs növekedését okozza. A béta-sejtek megfelelő növekedésének megszakadása 2-es típusú cukorbetegséghez vezet [6–12]. Hosszú távú, magas zsírtartalmú étrend után a béta-sejtek szaporodása jelentősen csökkent és szigetek sejtes öregedését figyelték meg. Nem tudtunk béta-galaktozidáz festést végezni a 4 hónapos egerek szigetein. Ha azonban az öregedés leállítja a szaporodást, akkor az ezt követő nekrózis és apoptózis csökkenti a szigetek tömegét. A sejtosztódás és a sejthalál független események, mint az idegsejtek esetében, de a béta-sejtek érzékenyek a lipoglükotoxicitásra, és a szigetecskék tömegét apoptózis csökkentheti. A csökkent hipertrófia szintén hozzájárulhat a szigetek tömegének csökkenéséhez. Ezen megállapítások alapján megítélve, a béta-sejtek öregedése csökkent béta-sejtek tömegét eredményezi, és 2-es típusú cukorbetegséghez vezethet.
Összegzésképpen elmondható, hogy a diéta által kiváltott 2-es típusú diabéteszes egerekben csökken a béta-sejtek proliferációja és a sejtek öregedése. A sejtek öregedését a béta-sejtek kompenzációs gyors szaporodása okozhatja, amely szükséges a megfelelő béta-sejtek tömegének fenntartásához és/vagy az ROS felhalmozódásához a béta-sejtekben. A béta-sejtek öregedése az inzulin elégtelen felszabadulásához vezet a csökkent béta-sejtek tömegének következményeként, és hozzájárul a diéta által kiváltott cukorbetegség patogeneziséhez.
- Megjegyzés A humán parainfluenza vírus 3 típusú HN-receptor kölcsönhatásának hozzájárulása a patogenezishez
- A metformin addíció javítja a súlygyarapodást, csökkenti az inzulinigényt az 1-es típusú cukorbetegségben
- Az életmód és a viselkedés változásának elősegítése túlsúlyos, 2-es típusú cukorbetegségben szenvedő gyermekeknél és serdülőknél
- A metformin növeli a mérsékelt vérszegénység kockázatát a 2-es típusú cukorbetegségben
- Metformin a 2-es típusú diabetes mellitus (T2DM) és a kapcsolódó szövődmények megelőzésére