A fehérje növelése a szénhidrát költségén az étrendben csökkenti a glükóz felhasználását, mint a glükóz kímélő hatást patkányokban
Magdalena Stepien
1 INRA/AgroParisTech, CNRH-IdF, UMR914 Táplálkozási élettan és befogadó magatartás, Párizs, Franciaország,
2 INRA, CNRH-IdF, UMR914 Táplálkozási élettan és befogadó magatartás, Párizs, Franciaország,
Claire Gaudichon
1 INRA/AgroParisTech, CNRH-IdF, UMR914 Táplálkozási élettan és befogadó magatartás, Párizs, Franciaország,
2 INRA, CNRH-IdF, UMR914 Táplálkozási élettan és befogadó magatartás, Párizs, Franciaország,
Gilles Fromentin
1 INRA/AgroParisTech, CNRH-IdF, UMR914 Táplálkozási élettan és befogadó magatartás, Párizs, Franciaország,
2 INRA, CNRH-IdF, UMR914 Táplálkozási élettan és befogadó magatartás, Párizs, Franciaország,
Patrick Even
1 INRA/AgroParisTech, CNRH-IdF, UMR914 Táplálkozási élettan és befogadó magatartás, Párizs, Franciaország,
2 INRA, CNRH-IdF, UMR914 Táplálkozási élettan és befogadó magatartás, Párizs, Franciaország,
Daniel Tomé
1 INRA/AgroParisTech, CNRH-IdF, UMR914 Táplálkozási élettan és befogadó magatartás, Párizs, Franciaország,
2 INRA, CNRH-IdF, UMR914 Táplálkozási élettan és befogadó magatartás, Párizs, Franciaország,
Dalila Azzout-Marniche
1 INRA/AgroParisTech, CNRH-IdF, UMR914 Táplálkozási élettan és befogadó magatartás, Párizs, Franciaország,
2 INRA, CNRH-IdF, UMR914 Táplálkozási élettan és befogadó magatartás, Párizs, Franciaország,
A kísérletek megtervezése és megtervezése: CG DAM. Végezte a kísérleteket: MS CG PE DAM. Elemezte az adatokat: GF PE DT DAM. Hozzájáruló reagensek/anyagok/elemző eszközök: GF DT. Írtam a cikket: MS DT DAM.
Absztrakt
Bevezetés
A test tápanyaghomeosztázisa a hormonális és metabolikus adaptációk ellenőrzése alatt áll, és változásokkal jár az étrendi és táplálkozási viszonyokra érzékeny gének expressziójában (Waterlow, FAO 1981). A fehérje növelését a szénhidrátok rovására javasolták a súlycsökkentő programok stratégiájaként, a rendszeres mérsékelt testmozgás ajánlásaival együtt. A magas fehérjetartalmú étrend elősegíti a fogyást, emellett kíméli a sovány testtömeget [1], [2], [3], [4] és csökkenti a szív- és érrendszeri betegségek kockázatát egészséges és elhízott nőknél [5], [6]. Ezeket a hatásokat általában a fehérjék magas szatírációs erejének tulajdonítják [1], [7], de a fehérje és az energia metabolizmusában szerepet játszó metabolikus utak specifikus adaptációinak is. Ennek eredményeként szükség van az étrend fehérjetartalmának növelésével kiváltott metabolikus alkalmazkodás jobb megértésére.
A megnövekedett fehérjebevitelhez való alkalmazkodás először olyan mechanizmusokat foglal magában, amelyek lehetővé teszik az aminosavak testbe történő bejuttatásának drámai növekedését, azáltal, hogy növelik az ammónia eltávolításában és a nitrogén egyensúly fenntartásában szerepet játszó utakat [8]. Patkányokban és emberekben a magas fehérjebevitel elősegíti a fehérje oxidációját, csökkenti vagy nem változtatja meg a szénhidrát oxidációt, fokozza és fenntartja a lipid oxidációt [9], [10], [11], [12], [13], [14], a diéta összetételéről [15]. Az aminosav katabolizmusa fokozódik [16], [17], a karbamidciklus enzimek aktiválásával együtt [18], [19], [20]. Kimutatták azt is, hogy a fehérjebevitel negatív zsíregyensúlyhoz vezet [21], [22], csökken a lipogén enzimek expressziója [23], [24] és csökken a glükóz zsírszövetek általi eltávolítása [25], [ 26], amely a csökkent szénhidrát/fehérje arányt követő csökkent inzulinválaszból származhat. Megállapítást nyert az is, hogy az aminosavak táplálva is táplálják a glükoneogenezist, ha táplált állapotban is bőségesen szállítják őket. Ezen okok miatt a magas fehérjetartalmú étrendnek pozitív hatásai vannak a patkányok [24], [25] és az emberek [28] glükóz homoeostasisára.
Jelen tanulmányban arra törekedtünk, hogy jellemezzük azoknak az anyagcsere-változásoknak az időbeli lefolyását, amelyek a normál fehérje/magas szénhidráttartalmú étrendből a magas fehérjetartalmú/alacsony szénhidráttartalmú izokalórikus étrendbe történő adaptáció során két hét alatt alakulnak ki. Vizsgáltuk az aminosav-szubsztrátok energia-anyagcserébe történő átvitelében részt vevő számos szerv energetikai útjának szabályozásában részt vevő fő gének kifejeződését, a hasnyálmirigy-hormonok változását és a máj glükózfelvételét. Ezzel párhuzamosan kalorimetriás vizsgálatot végeztünk a génexpressziós eredmények által javasolt metabolikus orientációk in vivo megerősítésére.
Eredmények
Testtömeg, glikémia, májglikogén és hasnyálmirigy-hormonok
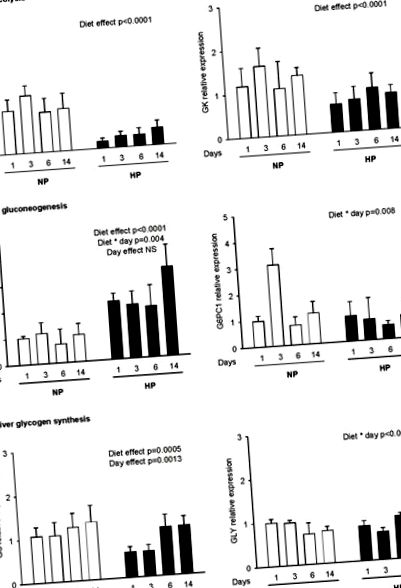
A génexpressziót meghatároztuk a következő enzimekben: (a) glikolízis (L-PK, GK), (b) glükoneogenezis (PEPCK, G6PC1) és (c) glikogenogenezis (glikogenin, GS) 2 órával a kalibrált étkezés után. 4 g NP vagy HP táplálékból áll, patkányoknak, akiket korábban normál vagy magas fehérjetartalmú étrendben tápláltak 1, 3, 6 és 14 napig (NP1, NP3, NP6, NP14 és HP1, HP3, HP6, HP14). Az mRNS szinteket valós idejű RT-PCR-rel mértük és expresszáltuk a referencia génhez (18S) képest. Az adatokat átlagként ± SEM fejezzük ki az NP1-hez viszonyítva (n = 5). A statisztikai különbségek (P 1b. ábra és 2. táblázat ). A vesében nem figyeltek meg szignifikáns változást az NP és a HP táplált patkányok között ( 2. táblázat ). A májban a PEPCK gén expressziója magasabb volt HP-ben, mint NP patkányokban ( 1b. Ábra ). A 14. napon a PEPCK gén expressziója négyszeresére nőtt a HP14-ben az NP14 patkányokhoz képest (3,38 ± 0,83 vs. 1,02 ± 0,42). Ezzel szemben a G6PC1 mRNS-t sem az étrend, sem az adaptáció időtartama nem befolyásolta ( 1b. Ábra ), bár interakciót figyeltünk meg a diéták és a nap között, mivel NP patkányokban 3 nap múlva átmenetileg növekedett.
2. táblázat
| Enzim expresszió | Szövet | NP14 | HP14 | |
| Glükóz anyagcsere | ||||
| Glikogénszintézis | GS1 | Gastrocnemius | 9,81 ± 0,89 | 10,53 ± 0,92 |
| Soleus | 5,22 ± 1,44 | 9,14 ± 4,09 | ||
| GYG1 | Gastrocnemius | 8,08 ± 0,74 | 8,36 ± 0,33 | |
| Soleus | 6,70 ± 2,99 | 5,95 ± 2,66 | ||
| Glükoneogenezis | PEPCK | Vese | 45,16 ± 5,86 | 48,53 ± 1,66 |
| G6PC1 | Vese | 2,52 ± 3,65 | 3,65 ± 0,57 | |
| Lipid anyagcsere | ||||
| Lipogenezis | ACC | Epidydymalis zsírszövet | 41,1 ± 14,4 | 54,1 ± 4,8 |
| Retroperitonealis zsírszövet | 100,2 ± 2,9 | 104,1 ± 15,4 | ||
| FAS | Epidydymalis zsírszövet | 39,2 ± 5,7 | 30,2 ± 7,9 | |
| Retroperitonealis zsírszövet | 95,6 ± 15,1 | 98,10 ± 11,3 | ||
| Lipolízis | HSL | Epidydymalis zsírszövet | 0,09 ± 0,02 | 0,12 ± 0,01 |
| Retroperitonealis zsírszövet | 0,51 ± 0,10 | 0,23 ± 0,05 * | ||
| β-oxidáció | CPT1b | Gastrocnemius | 18,27 ± 2,31 | 13,15 ± 2,75 |
| Soleus | 11,57 ± 2,82 | 13,69 ± 1,82 | ||
| ACOX1 | Gastrocnemius | 5,94 ± 0,89 | 4,47 ± 0,51 | |
| Soleus | 1,06 ± 0,19 | 1,61 ± 0,20 | ||
| βHAD | Gastrocnemius | 1,43 ± 0,13 | 1,33 ± 0,15 | |
| Soleus | 1,47 ± 0,25 | 1,20 ± 0,10 | ||
A lipidtartalom étkezés utáni profilja és a lipidanyagcserében részt vevő gén expressziója
A lipogenezis szabályozásában bekövetkezett változások értékeléséhez megmértük az AcetylCoAcarboxylase (ACC) és a zsírsav szintáz (FAS) expresszióját a májban és a zsírszövetben. A lipolízis és a ß-oxidáció aktivációs állapotát a zsírszövetben történő HSL (hormonérzékeny lipáz) expresszióból, valamint a máj és az izmok CPT1, βHAD és ACOX1 expressziójából értékeltük ( 2. ábra és 2. táblázat ), ill.
A génexpressziót meghatároztuk az (a) lipogenezisben (ACC, FAS) és (b) lipidoxidációban (CPT1, ACOX1, HAD) részt vevő kulcsfontosságú enzimek esetében 2 órával egy kalibrált étkezés után, amely 4 g NP vagy HP étrendből állt. patkányok normál vagy magas fehérjetartalmú étrendet tápláltak 1, 3, 6 és 14 napig (NP1, NP3, NP6, NP14 és HP1, HP3, HP6, HP14). Az mRNS szinteket valós idejű RT-PCR-rel mértük és expresszáltuk a referencia génhez (18S) képest. Az adatokat átlagként ± SEM fejezzük ki az NP1-hez viszonyítva. A statisztikai különbségek (p 2a. Ábra ). Ezenkívül, összehasonlítva a glikolitikus enzimeket kódoló géneknél korábban megfigyeltekkel, az ACC és FAS expressziója jobban gátolt volt a HP táplálás kezdetén (mindkét gén esetében körülbelül négyszeres), mint két hét múlva, amikor a csökkenés az ACC és FAS esetében csak 2,2, illetve 1,6-szoros, és azonos máj triglicerid tartalmat eredményezett (22,9 ± 11,6 mg/g NP-vel táplált patkányokban és 17,0 ± 11,6 mg/g máj HP táplált patkányokban, illetve). A zsírszövetben a HP táplálás egyik sem befolyásolta az ACC és FAS expressziót ( 2. táblázat ), sem a zsírszövet-triglicerid (904,4 ± 93,25 és 902,9 ± 109,8 mg/g a HP14 és az NP14 esetében) és a glicerin (8,9 ± 7,2 és 12,4 ± 13,3 mg)/g a HP14 és az NP14 esetében).
ß-oxidáció: A máj zsírsav-oxidációjának hatása nem volt megfigyelhető. A CPT1, ßHAD és ACOX1 génexpressziója nem különbözött az NP-vel és a HP-vel táplált állatokban ( 2b. Ábra ). A soleus és a gastrocnemius izmokban a CPT1b, ACOX1 és βHAD expressziója is változatlan volt két hét HP diéta után ( 2. táblázat ). Azonban a retroperitoneális zsírszövetben, a hormonérzékeny lipázban (HSL), a génexpresszió szignifikánsan csökkent a HP patkányokban (p = 0,04), az epididymális zsírszövetben azonban nem ( 2. táblázat ).
Energiafelhasználás, makrotápanyagok oxidációja és tápanyagmérleg
Az energiafogyasztást és a tápanyagok oxidációját a termoneutralitás közelében (27 ° C) vizsgálták egy héten NP tápanyaggal táplált patkányokban (NP), majd az 1., 3., 6. és 14. napon a HP étrendhez való alkalmazkodás során.
A makrotápanyagok egyensúlyát a 4 órás periódus alatt értékeltük a teljes anyagcseréhez, miután 4 g megfelelő étrendet tartalmazó kalibrált ételt fogyasztottunk. A mérleget az abszorbeált makrotápanyagok és az oxidált makrotápanyagok közötti különbségként számoltuk. A patkányokat egy hétig normál fehérje (NP) táplálékkal etették, majd 0, 1, 3, 6 és 14 napig HP étrendre váltottak (NP, HP1, HP3, HP6, HP14). Az adatok átlag ± SEM. A jelentőséget az egyirányú ANOVA (P 5. ábra ). Ezeket az adaptációkat főként az aminosav-felhasználás növekedése jellemzi, amely párhuzamos a glükóz-felhasználás csökkenésével. Az adaptáció előrehaladtával azonban a glükóz oxidatív útvonalakba jutása fokozatosan növekedett a neoglükogén útvonalak felfelé történő szabályozására és a glikogén útvonalak helyreállítására adott válaszként, amint azt a génexpressziós módosítások sugallják. Másrészt a lipid anyagcserében részt vevő mRNS-ek azt sugallják, hogy a zsírsav oxidációja nem módosul jelentősen, de a glükózzal kapcsolatos de novo zsírsavtermelés (lipogenezis) gyorsan és tartósan csökken. Feltételezzük, hogy ezt a csökkenést a magas fehérjetartalmú étrend mellett jelentett zsírtömeg-csökkenés fő tényezőjének kell tekinteni.
Az étrend magasabb fehérjetartalma fokozta a fehérje oxidációját és a karbamidtermelést. A glükoneogenezis első szabályozott lépése felfelé volt szabályozva (PEPCK), de nem az utolsó (G6PC1). Az étrend alacsonyabb CHO-tartalmával csökkent a glükóz-oxidáció és a máj glikogén-tartalma, egyidejűleg a glikolitikus gének expressziójával (GK, LPK), alacsonyabb lipogenezist indukálva (ACC, FAS). A diéta stabil zsírtartalma nem okozott változásokat a β-oxidációban (CPT1, ACOX1, βHAD), amely csak átmenetileg emelkedett csak a HP diéta első napját követően.
A glükóz- és aminosav-anyagcsere változásai javíthatják a glükóz homeosztázisát, miután a szénhidrátot fehérjére helyettesítették az étrendben, ahogy mások [24], [30], [41] megfigyelték, és Leyman és Baum [42] áttekintették. Ugyanakkor a glikolízis lefelé történő szabályozása a máj és a zsírszövet lipogenezisének csökkenését indukálta [43], [44]. A lipogén enzimek (ACC, FAS) mRNS-szintjét a HP táplálása már az első napon csökkentette a májban, míg a zsírszövetekben nem észleltek változást. Másrészt nem figyeltünk meg szignifikáns változásokat a lipidoxidációban részt vevő enzimeket kódoló gén expresszióban (CPT1, ACOX1 és βHAD), és a lipid oxidációban nem észleltünk változásokat, közvetlenül közvetett kalorimetriával mérve. Ezenkívül a zsírszövetekből a zsírsavak felszabadulásáért felelős enzim, a HSL expressziója nem változott a szubkután zsírszövetben, és a retroperitoneálisban kétszer csökkent, ami összhangban áll az mRNS-t kódoló enzimek β-oxidáció a májban vagy az izmokban. Ennek megfelelően valószínűleg a máj lipogenezisének lefelé történő szabályozása jelenti a fő folyamatot a HP-vel táplált patkányok csökkent zsírtartalmában.
Eredményeink együttesen azt mutatják, hogy az energia-anyagcsere időbeli adaptációja igazodik a megnövekedett fehérjebevitelhez a szénhidrát rovására. Ez az adaptáció magában foglalja az aminosavak fokozottabb hozzájárulását az energiafelhasználáshoz és a de novo máj glükóztermeléséhez. Ez utóbbi a glikolízisben és a lipogenezisben szerepet játszó csökkent mRNS-kódoló enzimekkel együtt részt vesz a glükóz homeosztázisnak az étrendi glükóz csökkent mennyiségéhez való adaptálásában. Ráadásul a kéthetes adaptáció után megfigyelt kevésbé negatív szénhidrátegyensúly alacsonyabb zsírmegsemmisülést eredményezhet, ami viszont a csökkent lipogén enzim génexpresszióval (ACC és FAS) együtt, miközben a lipid oxidációs gén expressziója és az energiafelhasználás változatlan marad a HP diéta alatt, megmagyarázhatja a HP diétával táplált alanyoknál általában megfigyelhető alacsonyabb zsírgyarapodást.
Anyagok és metódusok
Állatok és diéták
A kísérleti protokollt a francia nemzeti állatgondozási bizottság hagyta jóvá. Két külön vizsgálatot végeztek, az egyiket a génexpressziós profilok, a másikat a légzéscsere mérésére szánták. Nyolcvan hím Wistar patkányt (Harlan, Franciaország), kezdeti testtömege 160–180 g, egyenként egy szabályozott hőmérsékletű helyiségben (22 ° C ± 1) helyeztünk el, 12 órás fordított fény/sötét ciklus alatt (világít 18-kor: 00). Az állatokat az első héten normál fehérjetartalmú táplálékkal (NP) etették, majd 1, 3, 6 és 14 napig magas fehérjetartalmú (HP) vagy normál fehérjetartalmú étrendhez (NP) rendelték őket (lásd alább). Az NP és a HP étrendje 14% és 50% teljes tejfehérjét tartalmazott energiaként ( 3. táblázat ), ill. A diétákat az „Unité de préparation des aliments”, INRA, Jouy-en-Josas, Franciaország készítette az AIN-93M követelményeinek megfelelően [50]. A diéták fehérjetartalmát izoenergetikailag keményítőre és szacharózra cserélték, és a zsírtartalmat állandó értéken tartották. A patkányok folyamatosan szabadon hozzáférhettek a vízhez, de a sötét fázisban két időszakban hozzászoktak az eledelhez: korlátozott mennyiségű 4 g étrend 9:00 és 9:30 között, amelyet teljesen elfogyasztottak, majd szabad hozzáférés diéta 12:00 és 18:00 között. A testtömegeket naponta 18: 00-kor mérték.
- ILD táplálkozási kézikönyv Növekvő fehérje az étrendben UCSF egészség
- Magas fehérjetartalmú étrend 5 csirkesaláta receptek, amelyeket az étrendbe felvehet - NDTV étel
- Magas fehérjetartalmú gomba leves krém; A jó étrend
- A magas fehérjetartalmú étrend nem olyan rossz neked, mint a dohányzás ápolási idők
- Hogyan lehet elegendő fehérjét, kalciumot és vasat kapni növényi étrenden