A citromfű hatása (Cymbopogon citratus Stapf) tea 2-es típusú cukorbetegség patkány modellben
Absztrakt
Háttér
Citromfű (Cymbopogon citratus A Stapf) tea egy széles körben elfogyasztott ital táplálékként és a diabetes mellitus (DM) orvoslására Afrikában helyben. Jelen tanulmány célja a citromfű tea (LGT) antidiabetikus hatásának vizsgálata patkányok 2-es típusú cukorbetegség (T2D) modelljében.
Mód
A T2D fruktóz-sztreptozotocin (STZ) állatmodelljét alkalmaztuk, és az LGT-t úgy készítettük, hogy 10 percig forraltuk vízben, hagytuk lehűlni és 0,25 vagy 0,5% (ad libitum) hőmérsékleten adtuk 4 hétig a T2D patkányoknak.
Eredmények
Az LGT magasabb fitokémiai tartalmat mutatott a hidegvizes kivonathoz képest. A diabéteszes kezeletlen állatok jelentősen (o
Bevezetés
A C. citratus a citromfű néven ismert Ázsia, Afrika és Amerika őshonos, de széles körben termesztik mérsékelt és trópusi régiókban. Aromás fűszerű növény, hosszú, karcsú zöld levelekkel, és a trópusi és szubtrópusi országokban széles körben elterjedt [8]. Több évtizede a citromfűről számoltak be, hogy számos folklór, kozmetikai és táplálkozási célra széles körben használják. Nigériában, Egyiptomban, Dél-Afrikában és Tanzániában a citromfű teát (LGT) fogyasztják a DM és más kapcsolódó rendellenességek, például a magas vérnyomás és az elhízás kezelésére [9,10,11,12]. Az LGT fő hatóanyagai a fenolok, flavonoidok és terpenoidok voltak, amelyek tartalma magasabbnak bizonyult a hidegvíz-kivonathoz képest [13].
Anyagok és metódusok
Növényi anyag
A friss citromfűt 2018. januárjában gyűjtötték össze Zaria-ból, Kaduna állam, Nigéria. A mintát a nigériai Zaria államban található Ahmadu Bello Egyetem Biológiai Tudományi Osztályának herbáriumi egységében hitelesítették, és ennek megfelelően 1882-es számú utalványmintát helyeztek letétbe. A levélmintát azonnal mossuk és 2 hétig árnyékban szárítjuk állandó tömegig, és finom porrá őröljük.
Tea elkészítése
A citromfű tea (LGT) készítményt úgy készítették, hogy utánozták a cukorbetegség kezelésére helyben használt vagy táplálékként fogyasztott készítmény protokollokat, és összhangban voltak az iszlám [17] módszerével. Röviden: a finom por alakú minták; 0,25 g/100 ml és 0,5 g/100 ml oldatokat készítünk 10 percig vízben forralva, hagyjuk szobahőmérsékletre hűlni és Whatmann szűrőpapíron (1. sz.) Átszűrjük. A szűrleteket az állatokhoz a 4 hetes intervenciós periódus alatt ad libitum adagoltuk. A fitokémiai elemzéshez a szűrletet rotációs bepárlóval bepároljuk, így kapjuk az extraktumot.
Fitokémiai elemzés
Flavonoid tartalom
A flavonoidok mennyiségi meghatározásához Bohm és Koupai-Abyazani [18] módszerét alkalmazták. Röviden, 10 g mintát ismételten extraháltunk 100 ml 80% -os metanolban. Az elegyeket Whatman 42-es szűrőpapírral (125 mm) szűrjük. A szűrleteket tégelybe visszük, vízfürdőn szárazra pároljuk, és állandó tömegre mérjük.
Teljes fenoltartalom
Chang és mtsai. Folin-Ciocalteu módszere. [19] -et alkalmaztuk a minta fenoltartalmának számszerűsítésére. Öt grammot (5 g) a mintákat 50 ml éterben 15 percig forralunk, majd az extraktumok 5 ml-ét 50 ml-es lombikba pipettázzuk. 2 ml ammónium-hidroxid-oldatot és 5 ml amil-alkoholt is adunk a mintákhoz, és a jelig töltjük. Hagytuk 30 percig reagálni a szín kialakulása érdekében; az abszorbanciát 550 nm-en mértük. Gallusavat használtunk egy standard görbe kalibrálásához. Az eredményeket mg galluszsav-ekvivalens (mgGAE)/g növényi szövet száraz tömegére vonatkoztatva fejezzük ki.
Alkaloid tartalom
A Naili és mtsai. [20] módszert alkalmaztunk az alkaloid tartalom meghatározására. 5 g mintát lemérünk egy 250 ml-es főzőpohárba, és 200 ml 10% -os etanolos ecetsavat adunk hozzá, és lefedjük, majd 4 órán át állni hagyjuk. Az elegyeket leszűrjük, és az extraktumokat vízfürdőn bepároljuk az eredeti térfogat egynegyedéig. Koncentrált ammónium-hidroxidot adunk cseppenként mindegyik kivonathoz, amíg a kicsapódás teljes nem lesz. A teljes oldatokat hagyjuk ülepedni, a csapadékokat összegyűjtjük, híg ammónium-hidroxiddal mossuk, majd szűrjük. A maradékokat lemértük és alkaloid tartalomként regisztráltuk.
Szaponin tartalom
Obadoni és Ochuko [21] módszerét alkalmazták a szaponin tartalom meghatározására. 20 g mintát egy kúpos lombikba tettünk, és 100 ml 20% -os vizes etanolt adtunk hozzá. Az elegyeket forró vízfürdőn 4 órán át melegítjük, folyamatos keverés közben, körülbelül 55 ° C-on. Az elegyeket leszűrjük, és a maradékokat további 200 ml 20% -os etanollal extraháljuk. Az extraktumot vízfürdőn, körülbelül 90 ° C-on 40 ml-re csökkentettük. A koncentrátumokat 250 ml-es választótölcsérbe helyeztük, és 20 ml dietil-étert adtunk hozzá, és erőteljesen rázattuk. A vizes réteget kinyertük, miközben az éteres réteget eldobtuk. A tisztítási folyamatot megismételtük. 60 ml térfogat n-butanolt adunk hozzá. Az egyesített n-butanol-extraktumokat kétszer 10 ml 5% -os vizes nátrium-klorid-oldattal mossuk. A maradék oldatokat vízfürdőben melegítettük. Párologtatás után a mintákat a kemencében állandó tömegre szárítjuk.
Tannin tartalom
A tannin-tartalmat az AOAC szerint vizsgáltuk [22]. A készítmények vizes oldatait (25 ml) átvisszük 1 literes Erlenmeyer-lombikba, majd 25 ml Indigo-oldatot és 750 ml desztillált ionmentes vizet adunk hozzá. A titráláshoz 0,1 N vizes KMnO4-oldatot használtunk, amíg a kék színű oldat zöld színűvé nem változott. Ezután néhány csepp, amíg az oldat aranysárgává nem válik. Indigokarmin standard oldatát készítettük. A vakpróbákat 25 ml indigokarmin oldat és 750 ml desztillált víz keverékének titrálásával hajtottuk végre.
Kísérleti állatok és csoportosítás
Negyvenkét (42) hím Wistar patkányt nyertünk a Nigériai Zmari Ahmadu Bello Egyetem Gyógyszerésztudományi Karának Farmakológiai Tanszékéről, kezdeti átlagos testtömegük 211,01 ± 17,05 g. Az állatok kezelése és felhasználása összhangban volt a Laboratóriumi állatok gondozására és felhasználására vonatkozó Országos Egészségügyi Intézetek útmutatójával. A kísérleti állatok kezelését és felhasználását a nigériai Zaria állambeli Ahmadu Bello Egyetem Állatkutatási Etikai Bizottsága hagyta jóvá. Az állatokat átlátszó ketrecekben (3 vagy 4 állat/ketrec) 12 órás világos-sötét ciklusban helyeztük el, és a teljes kísérleti időtartam alatt standard patkánypellet-táplálékkal láttuk el. Az állatokat véletlenszerűen hat csoportba osztottuk hét állatból, nevezetesen; NC: Normal Control, DBC: Diabetic Control, DLTL, Diabetic + LGT alacsony dózisa (0,25%), DLTH, Diabetes + LGT nagy dózisa (0,5%), DMF: Diabetic + metformin (150 mg/ttkg), NLTH: Nem cukorbeteg + nagy dózisú (0,5%) LGT. Az állatokat 1 hétig hagyták akklimatizálódni a kísérlet megkezdése előtt. Az LGT és a standard metformin esetében alkalmazott dózisok kiválasztása a kísérleti tanulmányon és a rendelkezésre álló szakirodalomon alapult [23, 24].
2-es típusú cukorbetegség (T2D) kiváltása
A T2D két fő patogénjének, az inzulinrezisztenciának és a hasnyálmirigy β-sejtjeinek részleges diszfunkciójának kiváltására Wilson és az iszlám módszerét [25] alkalmazták. Röviden, a kísérlet első 2 hetében a DBC, DLTL, DLTH és DMF csoportba tartozó állatokat 10% -os fruktózoldattal (ad libitum) láttuk el inzulinrezisztencia kiváltására, míg az állatokat az NC és az NLTH csoportokban. a csoportokat normál ivóvízzel látták el. Ezen időszak és egy éjszakai böjt után a citrátpufferben (pH 4,5) oldott 40 mg/ttkg alacsony streptozotocin (STZ) adagot intraperitoneálisan injektáltuk a DBC, DLTL, DLTH és DMF csoportba tartozó állatoknak, hogy részleges hasnyálmirigy β-sejtek diszfunkciója, míg az NC és NLTH csoportba tartozó állatokhoz hasonló térfogatú vivőanyag-puffert injektáltak. Egy héttel az STZ injekció után minden állat éhomi vércukorszintjét (FBG) megmértük a farokérből összegyűjtött vérben hordozható glükométerrel (Glucoplus Inc., Accucheck). Azokat az állatokat, akiknek FBG-szintje ≥ 200 mg/dl, cukorbetegeknek tekintették [26], míg az FBG-szinttel rendelkező állatokat $$ \ mathrm- \ mathrm = \ balra [\ balra (\ mathrm \ \ mathrm \ \ mathrm \ mathrm \ \) mathrm \ \ mathrm/ \ mathrm \ \ mathrm \ \ mathrm \ \ mathrm \ \ mathrm \ \ mathrm \ \ mathrm/\ mathrm \ right]/22.5\right] $$
Az LDL-koleszterint Friedewald et al. [27] egyenlet az alábbiak szerint:
Glikogén (mg/g májszövet) = (optikai sűrűség ismeretlen 0,5 x Vol. minta × 100 × 0,9) /.
A szövet optikai sűrűsége x g.
Statisztikai analízis
Minden adatot hét állat átlag ± SD-ként adunk meg. Az adatokat a varianciaanalízis (ANOVA) (SPSS for Windows, 22. verzió, IBM Corporation, NY, USA) elemzésével elemeztük Tukey-HSD több tartományú post-hoc teszt alkalmazásával. Az értékeket jelentősen eltérőnek ítélték meg a o
Eredmények
Az LGT mennyiségi fitokémiai tartalma
A citokfüves teában (LGT) található fitokemikáliák mennyiségét és a hidegvizes kivonatot az 1. táblázat mutatja be. A szaponinok kivételével az összes mennyiségileg meghatározott összetevő magasabb volt az LGT-ben a hidegvizes kivonathoz képest, bár statisztikailag nem (o > 0,05) különböznek egymástól. Az LGT-ben lévő összes fenol mennyisége azonban szignifikánsan (o 1. táblázat A citromfű tea és a hideg vizes kivonat fitokémiai tartalma
Az LGT hatása a takarmány- és folyadékbevitelre és az átlagos testtömeg változásra T2D patkányokban
A takarmány- és folyadékbevitel, valamint az átlagos testtömeg-változás adatait az 1. és 2. ábra szemlélteti. 1., illetve 2. ill. Megfigyelték, hogy a T2D indukciója szignifikánsan (o 0,05) összehasonlítva a DBC csoporthoz, valamint a kezelt cukorbeteg csoportokon belül. Ezenkívül nem volt szignifikáns (o > 0,05) hatás az LGT-vel és a standard metforminnal kezelt csoportokon belül (1. és 2. ábra).
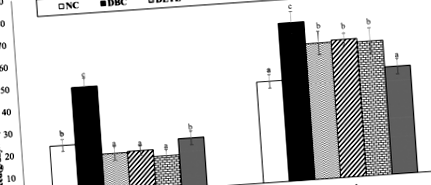
Az LGT hatása a heti vércukorszintre és az orális glükóz tolerancia tesztre T2D patkányokban
A heti vércukorszint eredményét a 3. ábra mutatja. Az adatok alapján a T2D indukciója után jelentős (o 3. ábra
Az LGT hatása a szérum inzulinra, a számított HOMA-IR és HOMA-β indexekre és egyéb biokémiai paraméterekre T2D patkányokban
A szérum inzulin eredményeit, valamint a számított HOMA-IR és HOMA-β indexeket a 2. táblázat tartalmazza. Az adatok szerint a szérum inzulinszint és a számított HOMA-β index szignifikánsan csökkent (o 0,05) különbséget figyeltünk meg a kezelt csoportokon belül a máj glikogén tartalmában, a szérum ALT, AST, ALP és albumin szintekben, a hatások hangsúlyosabbak voltak a DLTH-ban, mint a DLTL-csoportokban (3. táblázat).
Az LGT hatása a szérum lipidprofilokra T2D patkányokban
A szérum összes koleszterin (TC), trigliceridek (TG) és alacsony sűrűségű lipoprotein (LDL) koleszterinszintje szignifikánsan (o 5. ábra
Vita
Adataink azt mutatták, hogy a T2D indukciója csökkentette az átlagos testtömeget, polifágiát és polidipsziát okozott a cukorbetegségben nem kezelt állatokban. Ezek összefüggésben lehetnek a megnövekedett energiafogyasztással, a túlzott folyadékretencióval és a fokozott étkezési szokásokkal, hogy kompenzálják a testtömeg-csökkenést kontrollálatlan T2D-állapotban [33]. Az LGT 4 hétig tartó fogyasztása enyhítette ezeket a változásokat, ami a diabéteszes állapotból való lehetséges felépülést jelentette. Eredményeink összhangban vannak a hidegvizes kivonatot alkalmazó korábbi tanulmányokkal [11, 14], amelyeket a hiperglikémia jelentős csökkenése is alátámasztott az LGT-vel kezelt csoportokban.
Vizsgálatok kimutatták, hogy a krónikus, kontrollálatlan T2D a keringő inzulinszint csökkenéséhez vezethet, és megváltoztathatja a hasnyálmirigy integritását és működését [38, 39], amelyeket jelen tanulmányunkban megfigyeltünk. Ezenkívül a hasnyálmirigy-β-sejtek működését jelentősen enyhítette az inzulinrezisztencia megjelenése kezeletlen cukorbeteg patkányokban. Az LGT fogyasztása javította a hasnyálmirigy integritását a megnövekedett szérum inzulinszint révén, javítva a hasnyálmirigy β-sejtjeinek működését és az inzulinrezisztencia csillapítását (2. táblázat). Ez megmagyarázhatja a vércukorszint drasztikus csökkenését, mivel az emelkedett keringő inzulin és a javult β-sejt funkció megkönnyítette a glükóz mozgását a sejtekbe az energiatermelés érdekében.
A magas fruktóz tartalmú étrend fogyasztását a máj és az izom lipidszintjének megnövekedésével és a T2D-ben való felhalmozódásával társítják, a lipogenezis stimulálása révén [40]. Korábban a citromfű alkoholtartalmú vagy vizes kivonatok (200–1000 mg/ttkg) orális kezelése nem cukorbeteg, hiperlipidémiás és cukorbeteg állatokban antihiperlipidémiás hatást mutatott [11, 14, 41]. Ez megfelel jelenlegi adatainknak, és tovább erősíti a citromfű potenciálját a cukorbetegséggel összefüggő hiperlipidémia csökkentésében. Az emelkedett HDL-koleszterinszint a DBC csoportban, bár nem szignifikánsan (o > 0,05) eltérhet az NC-vel, annak oka lehet a testrendszer azon képessége, hogy több HDL-koleszterint termeljen, hogy semlegesítse a magasabb TC, TG és LDL-koleszterinszint negatív hatását.
Másrészt a citromfű alkoholos kivonat 2 hétig tartó kezelése nem mutatott hatást a szérum összes fehérjére, albuminra, ALT-ra, AST-re, ALP-ra és karbamidra [41]. Jelen vizsgálatunkban azonban az LGT beadása után csökkentek a változások (3. táblázat), ami az LGT jobb hatását jelzi az alkoholos kivonathoz képest. Ez a fitokemikáliák nagyobb mennyiségének és a hosszabb vizsgálati periódusnak tudható be. Vizsgálatunkban a DBC csoport alacsonyabb glikogéntartalma összekapcsolható a máj glikogén-foszforilázának stimulációjával, ami nyilvánvalóan növelheti a glükóz kibocsátását, és végül bonyolítja a hiperglikémiát cukorbetegségben. Érdekes módon az LGT kezelése enyhítette a változást, és tovább mutatja az LGT képességét a cukorbetegséggel összefüggő változások visszafordítására. Kimutatták, hogy a fenolok és a terpének, amelyek az LGT aktív összetevői, növelik a máj glükokináz aktivitását, ami növeli a glükóz felhasználását, elősegítve az energia tárolását glikogén formájában [42]. Ennélfogva a kezelt csoportokban megfigyelt megnövekedett glikogén-tartalom annak tulajdonítható, hogy a fő hatóanyagok gátolják a glükokináz aktivitást. Ez valószínűleg az LGT antidiabetikus hatásának mechanizmusa lehet.
Következtetés
Összegzésként elmondható, hogy az LGT orális beavatkozása antidiabetikus hatást mutatott a testtömeg-növekedés javításával, az élelmiszer- és folyadékbevitel és a hiperglikémia csökkentésével, a glükóz tolerancia képességének, az inzulinérzékenység, a β-sejtfunkciók és a diszlipidémia javításával patkányok T2D modelljében. Ezért eredményeink azt sugallják, hogy az LGT fogyasztása jó kezelési lehetőséget nyújthat a T2D-s betegek számára, jelentős mellékhatások nélkül, ami szintén alátámasztja a tea antidiabetikus állításait. További klinikai vizsgálatokra van szükség a megfigyelt hatásért felelős humán személyekben és specifikus hatóanyagokban kifejtett hatások megerősítéséhez.
Az adatok és anyagok rendelkezésre állása
A jelenlegi vizsgálat során felhasznált és/vagy elemzett adatkészletek ésszerű kérésre a megfelelő szerzőtől elérhetőek.
- A kávéfogyasztás, az elhízás és a 2-es típusú cukorbetegség egy mini-áttekintő SpringerLink
- A fokhagyma-kiegészítés hatása a 2-es típusú diabetes mellitus (T2DM) kezelésében a meta-elemzés
- Zeller és 2-es típusú cukorbetegség
- A lipid anyagcserezavarok korrekciója a diabetes mellitusban peptid gyógyszerekkel SpringerLink
- A diétamódosítás kihívásai a marginalizált és nem marginalizált felnőttek 2-es típusú cukorbetegségében